- 4.88 MB
- 2022-06-16 12:40:25 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
密级:论文编号:中囯农业科学院学位论文转和c/j/C:基因水稻对意大利蜜蜂的生态安全性EcologicalSafetyofTransgeniccry2AandcrylCRiceLinesfortheHoneyBee^Apismelliferaligustica博士研宄生:王园园指导教师:彭于发研宄员申请学位类别:农学博士专业:生研宄方向:培养单位:櫊研宄生院2015年5月
独仓Ij性声明本人声明所呈交的论文是我个人在导师指导下进行的研究工作及取得的研宄成果。尽我所知,除了文中特别加以标注和致谢的地方外,论文中不包含其他人己经发表或撰写过的研究成果,也不包含为获得中国农业科学院或其它教育机构的学位或证书而使用过的材料。与我一同工作的同志对本研宄所做的任何贡献均己在论文中作了明确的说明并表示了谢意。研究生签名:Ijg丨g时间:年月曰关于论文使用授权的声明本人完全了解中国农业科学院有关保留、使用学位论文的规定,即:中国农业科学院有权保留送交论文的复印件和磁盘,允许论文被查阅和借阅,可以采用影印、缩印或扫描等复制手段保存、汇编学位论文。同意中国农业科学院可以用不同方式在不同媒体上发表、传播学位论文的全部或部分内容。研究生签名:时间年月日导师签名:时间年月日
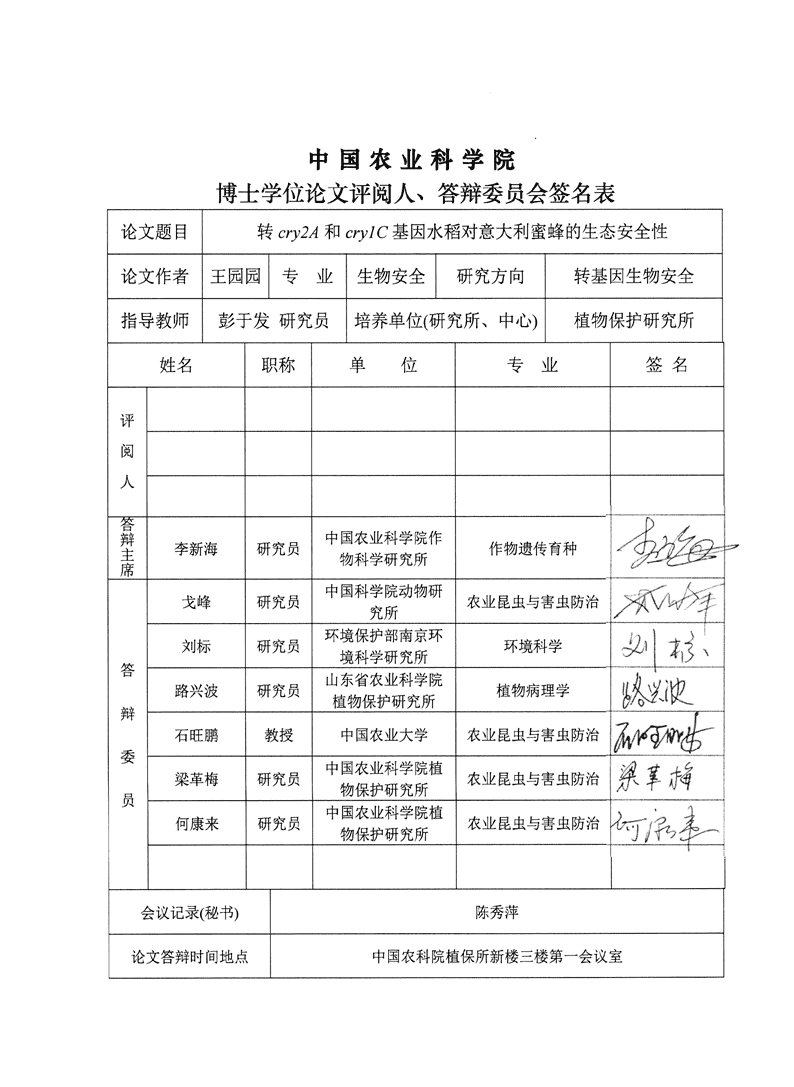
中国农业科学院博士学位论文评阅人、答辩委员会签名表论文题目转和oj/C基因水稻对意大利蜜蜂的生态安全性论文作者王园园专业生物安全研究方向转基因生物安全指导教师彭于发研究员培养单位(研究所、中心)植物保护研宄所姓名职称单位专业签名评阅人答辩中国农业科学院作李新海研宄员作物遗传育种主物科学研宄所席中国科学院动物研戈峰研宄员农业昆虫与害虫防治宄所环境保护部南京环刘标研究员环境科学境科学研究所4)5%答山东省农业科学院路兴波研究员植物病理学植物保护研宄所辩石旺鹏教授中国农业大学农业昆虫与害虫防治委中国农业科学院植梁革梅研究员农业昆虫与害虫防治物保护研宄所员中国农业科学院植何康来研究员农业昆虫与害虫防治物保护研宄所{会议记录(秘书)陈秀萍论文答辩时间地点中国农科院植保所新楼三楼第一会议室
密级:论文编号:中国农业科学院学位论文转cry2A和cry1C基因水稻对意大利蜜蜂的生态安全性EcologicalSafetyofTransgeniccry2Aandcry1CRiceLinesfortheHoneyBee,Apismelliferaligustica博士研究生:王园园指导教师:彭于发研究员申请学位类别:农学博士专业:生物安全研究方向:转基因生物安全培养单位:植物保护研究所研究生院2015年5月
Secrecy:No.ChineseAcademyofAgriculturalSciencesDissertationEcologicalSafetyofTransgeniccry2Aandcry1CRiceLinesfortheHoneyBee,ApismelliferaligusticaPh.D.Candidate:WangYuanyuanSupervisor:ProfessorPengYufaMajor:BiosafetySpecialty:GMOBiosafetyMay2015
摘要蜜蜂是重要的经济和社会性昆虫,其作为重要的指示性物种被用于转基因抗虫植物环境安全评估中。本研究系统地评价了分别表达Cry2A和Cry1C蛋白的两种抗虫转基因水稻新品系T2A-1和T1C-19对意大利蜜蜂(Apismelliferaligustica)幼虫和成虫的潜在影响。获得研究结果如下:1.基于已报道的幼虫人工饲料及饲喂方法,本研究发展了一种简单、灵敏的评价转基因杀虫蛋白对幼虫直接毒性影响的试验技术,并采用已知对蜜蜂幼虫具有毒性的大豆胰蛋白酶抑制剂SBTI作为阳性化合物,验证了所发展试验体系的有效性和灵敏性。2.采用所构建的试验体系,评价了取食高剂量的Cry2A及Cry1C蛋白对意蜂幼虫的潜在毒性,并以SBTI为阳性对照,牛血清蛋白BSA为阴性对照。结果显示:分别取食混入纯Cry1C(50μg/g)、Cry2A(400μg/g)或BSA(400μg/g)的人工饲料后,2日龄幼虫的存活率和生长发育没有受到影响;且中肠内总蛋白酶、类胰蛋白酶、氨肽酶和α-乙酸萘酯酯酶活性也没有显著变化;组织切片显示幼虫中肠表皮膜没有受到破坏。而取食了含有SBTI(1mg/g)的人工饲料后,2日龄幼虫的存活率显著下降,发育历期显著延长;中肠主要蛋白酶和解毒酶的活性也受到显著影响。通过PCR-DGGE分析也没有发现Cry2A(400μg/g)及Cry1C(50μg/g)蛋白对肠道细菌群落的结构产生显著影响。本试验结果说明了意大利蜜蜂幼虫对这两种Cry蛋白不敏感。3.评价了两种转基因抗虫水稻品系T2A-1和T1C-19花粉对意大利蜜蜂幼虫的潜在影响。分别将T2A-1和T1C-19水稻花粉按照0.5%(w:w)的比例直接添加至人工饲料中饲喂2日龄幼虫,发现虽然取食Bt花粉对蜜蜂幼虫中肠蛋白酶和解毒酶的生物活性有一定影响,但对蜜蜂幼虫的生命表参数如存活率、发育历期和老熟幼虫体重没有显著影响。4.将纯Cry2A和Cry1C蛋白分别以400μg/g和50μg/g的浓度加入到50%糖水中饲喂意蜂成蜂,并以SBTI(1mg/g和10mg/g)为阳性对照,BSA(400μg/g)为阴性对照,50%糖水为空白对照。饲喂试验持续5周后,在Cry1C、Cry2A或BSA处理中,成蜂存活率和王浆腺腺泡直径均没有受到显著影响;中肠内的总蛋白酶、类胰蛋白酶、氨肽酶和α-乙酸萘酯酯酶活性均没有显著变化。而高浓度SBTI处理的成蜂存活率明显下降;低浓度SBTI处理中成蜂的存活率降低,王浆腺腺泡直径明显减小,且中肠主要酶活性也发生显著变化。PCR-DGGE分析显示:分别取食Cry2A和Cry1C蛋白5天、10天和15天后,意大利蜜蜂成蜂中肠的菌群结构也无明显变化。5.将水稻花粉、蜂蜜、水按5:4:1混匀饲喂意大利蜜蜂成蜂10天后,发现取食Bt水稻花粉的成虫存活率、王浆腺发育、中肠主要蛋白酶和解毒酶的活性与取食非Bt花粉意蜂相比均无显著差异。6.本研究试验结果说明:种植转基因抗虫水稻T2A-1和T1C-19不会对意大利蜜蜂带来影响。关键词:转Bt基因水稻,意大利蜜蜂,生态安全,非靶标影响,PCR-DGGEI
AbstractHoneybeeisanimportanteconomicandsocialinsect,andithasbeentraditionallyselectedasasurrogatespeciesintheregulatoryriskassessmentofgeneticallymodifiedcrops.Inthisstudy,acomprehensiveanalysiswereconductedtoassessthepoteintialimpactsoftwoBtricelines(T2A-1,T1C-19)onthehoneybeeApismelliferaligustica.Theresultsweresummarizedasfollows:1.Basedonthereporteddietsandrearingmethods,adietaryexposureassayhavebeendevelopedforassessingthedirecttoxicityofinsecticidalcompoundstoA.melliferaligusticalarvae.ThesensitivityandvalidationofthesystemwasconfirmedusingSBTIasapositivecompoundwhichwastoxictoA.melliferaligustica.2.Usingtheestablishedassay,thepotentialtoxicityofCry1CandCry2AproteinsfromBacillusthuringiensis(Bt)toA.melliferaligusticalarvaewasassessed,wherethe2-dbeelarvaewerefedartificialdietscontainingCry1C(50µg/g)orCry2A(400µg/g).Andtheassayusedthesoybeantrypsininhibitor(SBTI)asapositivecontrolandbovineserumalbumin(BSA)asanegativecontrol.Theresultsrevealedthatsurvivalanddevelopmentwereunaffected,theenzymaticactivities(t-Pro,TPS,AMP,α-NAE)ofA.melliferaligusticalarvaewerenotalteredandtheirmidgutsbrushbordermembranes(BBMs)werenotdamagedwhenlarvaewerefedBSA(400µg/g),Cry1C(50µg/g),orCry2A(400µg/g).However,thesurvivalratewasdecreased,thedevelopmenttimewasprolongedsignificantly,theenzymaticactivitieswereincreasedandBBMsweredamagedwhenA.melliferaligusticalarvaefedondietscontainedSBTI(1mg/g).Furthermore,PCR-DGGEexperimentswereconductedandfoundthatingestionofCry2AorCry1Cproteindidnotaffectedthestructureofbacterialcommunity.TheseresultsdemonstratethatA.melliferaligusticalarvaearenotsensitivetohighconcentrationofCry1CorCry2A.3.TheeffectsofpollenoftwoBtricelinesT2A-1andT1C-19on2-dlarvaeofA.melliferaligusticawereassessedusingtheestablishedassay.WhenfedontheartificialdietscontainingBtrice(T2A-1orT1C-19)pollen,survival,developmenttimeandweightofmaturelarvaewerenotsignificantlyaffected,whileeffectsontheenzymaticactivities(t-Pro,TPS,AMP,α-NAE)oflarvaeweredetected.4.Afterfedwith50%(w:w)sucrosesolutioncontainingCry2A(400µg/g),Cry1C(50µg/g)proteinorBSA(400µg/g,asanegegtivecontrol)for5weeksunderlaboratoryconditions,survivalandthemeandiametersofhypopharyngealglandaciniofA.melliferaligusticaadultswerenotsignificantlyaffectedcomparedtotheadultsthatfedpurediets(50%sucrosesolution).Andtheenzymaticactivities(t-Pro,TPS,AMP,α-NAE)ofA.melliferaligusticaadultswerenotaffectedbyCryproteinfeeding.Onthecontrary,survivalratewassignificantlydecreasedwhenfeedingonthedietscontaininghighconcentraionofSBTI(10mg/g);wheningestingthesurcosesolutioncontaininglowconcentraionofSBTI(1mg/g),survivalratewasreduced,themeandiametersofhypopharyngealglandaciniwereobviouslysmallerthanthatofpurediettreatment,andtheenzymaticactivities(t-Pro,TPS,AMP,α-NAE)wereasloaffected.Likewise,fedwithsucrosesolutioncontainingCry2A(400µg/g)orCry1C(50µg/g)proteinfor5days,10daysor15days,thestructureofbacterialcommunityinthegutofbeeadultswasnotsignificantlyII
affectedusingPCR-DGGEanalysis.5.WhenA.melliferaligusticaadultsweresuppliedthedietscontainingBtornon-Btricepollen,honeyandwaterattheratioof5:4:1for10days,therewerenosignificanteffectsonsurvivalrate,themeandiametersofhypopharyngealglandaciniandtheenzymaticactivities(t-Pro,TPS,AMP,α-NAE)ofA.melliferaligusticaadults.6.TheresultsfromthecurrentstudyrevealthatplantingofthetwoBtricelines(T2A-1andT1C-19)wouldhavenegligibleriskonthehoneybee,A.melliferaligustica.Keywords:Btrice,Apismelliferaligustica,Ecologicalsafety,Non-targeteffect,PCR-DGGEIII
目录第一章引言.....................................................................................................................11.1转基因作物的发展现状.....................................................................................11.1.1转基因作物种植情况...........................................................................................11.1.2转基因抗虫水稻研究进展...................................................................................31.2抗虫转基因作物风险评价程序.........................................................................41.3抗虫转基因植物对蜜蜂类影响的研究进展.....................................................41.3.1蜜蜂类昆虫概述...................................................................................................41.3.2对生长发育影响的研究.......................................................................................51.3.3对中肠酶活性影响的研究...................................................................................71.3.4对肠道微生物影响的研究...................................................................................81.3.5对蜜蜂行为的影响...............................................................................................91.4研究背景、内容及意义...................................................................................101.4.1研究背景.............................................................................................................101.4.2研究内容.............................................................................................................101.4.3研究意义.............................................................................................................10第二章Bt蛋白对意大利蜜蜂幼虫的潜在影响.............................................................112.1材料和方法.......................................................................................................112.1.1供试昆虫.............................................................................................................112.1.2供试试剂.............................................................................................................112.1.3主要仪器.............................................................................................................122.2试验内容...........................................................................................................122.2.1意大利蜜蜂幼虫人工饲料制备.........................................................................122.2.2意蜂幼虫人工饲养方法.....................................................................................132.2.3蜜蜂幼虫取食不同浓度SBTI的生物学反应..................................................132.2.4Bt蛋白对蜜蜂幼虫的毒性影响........................................................................132.2.4.1蜜蜂幼虫生命表参数观察..............................................................................13IV
2.2.4.2蜜蜂幼虫Bt蛋白摄取量检测........................................................................142.2.4.3Cry蛋白的生物活性检测...............................................................................142.2.4.4取食Cry蛋白对蜜蜂幼虫消化道酶活性影响.............................................142.2.4.5组织病理学试验..............................................................................................152.3数据分析...........................................................................................................162.4结果与分析.......................................................................................................162.4.1蜜蜂幼虫对SBTI的剂量反应..........................................................................162.4.2Bt蛋白对蜜蜂幼虫的毒性................................................................................162.4.2.1生命表参数影响..............................................................................................162.4.2.2蜜蜂幼虫Bt蛋白的摄取量............................................................................162.4.2.3Bt蛋白生物活性.............................................................................................192.4.2.4蜜蜂幼虫肠道酶活性......................................................................................192.4.2.5Cry蛋白对蜜蜂幼虫组织病理学影响...........................................................212.5讨论...................................................................................................................22第三章两种Bt水稻花粉对意大利蜜蜂幼虫的潜在影响............................................243.1材料和方法.......................................................................................................243.1.1供试昆虫.............................................................................................................243.1.2供试试剂.............................................................................................................243.1.3供试仪器.............................................................................................................253.1.4供试花粉.............................................................................................................253.2试验内容...........................................................................................................253.2.1意大利蜜蜂幼虫花粉――人工饲料的制备.....................................................253.2.2生命表参数试验.................................................................................................263.2.3意蜂幼虫对Bt蛋白的摄取量测定...................................................................263.2.4酶活测定试验.....................................................................................................263.3统计分析...........................................................................................................263.4结果分析...........................................................................................................263.4.1生命表参数.........................................................................................................26V
3.4.2蜜蜂幼虫对Bt蛋白的摄取量...........................................................................273.4.3意大利蜜蜂幼虫肠道酶活性测定.....................................................................273.5讨论...................................................................................................................28第四章Bt蛋白及Bt花粉对意大利蜜蜂成虫的毒性影响..........................................304.1材料方法...........................................................................................................304.1.1供试昆虫.............................................................................................................304.1.2供试花粉.............................................................................................................304.1.3供试试剂.............................................................................................................314.2Bt纯蛋白试验..................................................................................................314.2.1工蜂存活率测定.................................................................................................314.2.2王浆腺腺泡直径测定试验.................................................................................314.2.3意蜂中肠酶活性测定试验................................................................................324.2.4Bt蛋白摄取量分析............................................................................................324.3Bt花粉试验......................................................................................................324.3.1存活率测定试验.................................................................................................324.3.2王浆腺腺泡直径测定试验.................................................................................334.3.3意蜂中肠酶活性测定试验................................................................................334.3.4Bt蛋白摄取量测定............................................................................................334.4数据分析...........................................................................................................334.5结果与分析.......................................................................................................334.5.1Bt纯蛋白试验结果............................................................................................334.5.2Bt花粉试验........................................................................................................384.6讨论...................................................................................................................42第五章Bt蛋白对意大利蜜蜂肠道微生物的影响.........................................................445.1材料方法...........................................................................................................445.1.1供试昆虫.............................................................................................................445.1.2供试花粉.............................................................................................................445.1.3供试试剂.............................................................................................................44VI
5.1.4主要仪器.............................................................................................................445.2试验内容...........................................................................................................455.2.1意大利蜜蜂的饲喂.............................................................................................455.2.2样品DNA的提取及检测..................................................................................455.2.3PCR扩增............................................................................................................455.2.4DGGE图谱分析.................................................................................................465.2.516SrRNA基因文库与测序..............................................................................475.3结果分析...........................................................................................................475.3.1意大利蜜蜂幼虫肠道细菌群落结构检测.........................................................475.3.1.1DNA提取结果及PCR扩增结果...................................................................475.3.1.2DGGE图谱分析结果......................................................................................485.3.1.3DGGE图谱条带克隆测序结果分析..............................................................495.3.2意大利蜜蜂成虫中肠细菌群落结构检测.........................................................515.3.2.1DNA提取结果及PCR扩增结果...................................................................515.3.2.2DGGE图谱分析结果......................................................................................535.3.2.3DGGE图谱条带克隆测序结果分析..............................................................555.5讨论...................................................................................................................61第六章结论...................................................................................................................636.1结论...................................................................................................................636.2创新点...............................................................................................................646.3展望...................................................................................................................64参考文献.............................................................................................................................65致谢.....................................................................................................................................75个人简历.............................................................................................................................76VII
英文缩略表英文缩写英文全称中文名称BtBacillusthuringiensis苏云金芽孢杆菌GNAGalanthusnivalisagglutinin雪花莲凝集素PIproteaseinhibitor蛋白酶抑制剂CpTIcowpeatrypsininhibitor豇豆胰蛋白酶抑制剂SBTIsoybeantrypsininhibitor胰蛋白酶抑制剂PODPeroxidase过氧化物酶SODSuperoxideDismutase超氧化物歧化酶α-NAEα-NaphthylAcetateEsteraseα-乙酸萘酯酯酶RFLPrestrictedfragmentlengthpolymorphisms限制性片段长度多态性PCRpolymerasechainreaction聚合酶链式反应DGGEdenaturinggradientgelelectrophoresis变性梯度凝胶电泳T-RFsterminalrestrictionfragments末端限制性片段EC50concentrationfor50%ofmaximaleffect半最大效应浓度FWfreshweight鲜重DWdryweight干重BBMbrushbordermembrane刷状缘膜VIII
中国农业科学院博士学位论文第一章引言第一章引言1.1转基因作物的发展现状重组DNA技术的出现打破了不同物种间的遗传限制,使得植物遗传育种工作取得了巨大成就,转基因植物应运而生。1.1.1转基因作物种植情况转基因作物的种类很多,包括转基因抗虫作物和耐除草剂作物,还有其它性状,如改善作物品质,环境修复等性状转基因作物。其中转基因抗虫作物应用较为广泛。转入植物中的抗虫基因主要有苏云金芽孢杆菌(Bacillusthuringiensis,Bt)基因,雪花莲凝集素(Galanthusnivalisagglutinin,GNA)基因,蛋白酶抑制剂(proteaseinhibitor,PI)基因以及其它来源于动物、植物或微生物的基因目前国内外已经培育出多种抗虫转基因作物,如转基因棉花、玉米、油菜、番茄、小麦和水稻等(Maloneetal.,2008)。耐除草剂基因主要有耐草甘膦基因,并已经转入玉米、大豆等作物(陈德龙等,2013;王丽娟等;2013)。1996年,第一例转基因作物在美国商业化种植,当年全球总种植面积为170万公顷,随后,转基因作物种植面积每年增加8%,到2014年,全球总种植面积达到1.815亿公顷(James,2014)。商业化种植后的19年间,转基因作物的全球种植面积增加了100多倍,种植国家也从原来的美国和加拿大2个国家增加到了28个,其中包括20个发展中国家和8个发达国家,排名前十的国家转基因作物种植面积均超过100万公顷。美国是种植面积最大的国家,为7300万公顷,种植的转基因作物种类有玉米、大豆、棉花、油菜、苜蓿、木瓜和南瓜。巴西和阿根廷紧随其后,作物种类为大豆、玉米和棉花。中国种植转基因作物的面积为390万公顷,位列第六,种植种类有棉花、木瓜、白杨、番茄和甜椒。2014年孟加拉国首次批准种植转Bt基因茄子,越南和印度尼西亚分别已批准在2015年首次种植转基因玉米和耐旱甘蔗,届时亚洲转基因作物种植国总数将达到9个(James,2014)。1
中国农业科学院博士学位论文第一章引言图1.1全球转基因作物种植面积(James,2014)Figure1.1Globalareaofbiotechcrops(James,2014)表1.12014年全球转基因作物在各国的种植面积(百万公顷)(James,2014)Table1.1GlobalAreaofBiotechCropsin2014:byCountry(MillionHectares)(James,2014)排名国家种植面积(百万公顷)转基因作物1美国73.1玉米、大豆、棉花、油菜、甜菜、苜蓿、木瓜、南瓜2巴西42.2大豆、玉米、棉花3阿根廷24.3大豆、玉米、棉花4印度11.6棉花5加拿大11.6油菜、玉米、大豆、甜菜6中国3.9棉花、木瓜、白杨、番茄、甜椒7巴拉圭3.9大豆、玉米、棉花8巴基斯坦2.9大豆、玉米、棉花9南非2.7棉花10乌拉圭1.6大豆、玉米11玻利维亚1.0大豆12菲律宾0.8玉米2
中国农业科学院博士学位论文第一章引言表1.12014年全球转基因作物在各国的种植面积(百万公顷)(James,2014)(续)13澳大利亚0.5棉花、油菜14布基纳法索0.5棉花15缅甸0.3棉花16墨西哥0.2玉米17西班牙0.1棉花、大豆18哥伦比亚0.1棉花、玉米19苏丹0.1棉花20洪都拉斯<0.1玉米21智利<0.1玉米、大豆、油菜22葡萄牙<0.1玉米23古巴<0.1玉米24捷克共和国<0.1玉米25罗马尼亚<0.1玉米26斯洛伐克<0.1玉米27哥斯达黎加<0.1棉花、大豆28孟加拉国<0.1茄子总计181.51.1.2转基因抗虫水稻研究进展我国转基因抗虫水稻研究报道始于1989年,中国农业科学院生物技术中心杨虹等首次用原生质体电融合技术将Bt基因导入水稻中(杨虹等,1989)。1991年,谢道昕等又报道了通过花粉管通道技术将Bt基因导入水稻栽培种“中花11号”中(谢道昕和倪丕冲,1991)。转基因抗虫水稻的研究自此拉开序幕。国外转基因抗虫水稻的研究也获得巨大成功。1993年,日本科学家Fujimoto等获得转cry1Ab基因粳稻,首次报道了转入的Bt基因能够在转基因植株中高效表达。美国康奈尔大学在1993年成功将豇豆胰蛋白酶抑制剂CpTI基因导入水稻,并获得具有高效杀虫效果的抗虫水稻植株(莽克强,1993)。1996年,Wunn等于将cry1Ab基因导入籼稻中,获得对二化螟(ChilosuppressalisWalker)、三化螟(ScirpophagaincertulasWalker)有高效致死效应的转基因植株(Wünnetal.,1996);Duan等将马铃薯蛋白酶抑制剂基因导入水稻中,成功获得抗稻纵卷叶螟(Cnaphalocrocismedinalis)的水稻(Duanetal.,1996)。1997年,印度的Nayak将cry1Ac基因导入籼稻“IR64”,并用玉米泛素转移蛋白基因作为启动子,得到的转基因水稻对三化螟有很高的致死作用(Nayaketal.,1997);同年,国际水稻所Ghareyazi用“鸟枪法”获得转cry1Ab粳稻(Ghareyazieetal.,1997)。1998年,Cheng等利用“农杆菌介导法”分别将cry1Ab和cry1Ac基因导入水稻中,并获得Bt基因高效表达的抗虫水稻(Chengetal.,1998);Vain等利用“鸟枪法”将半胱氨酸蛋白酶抑制剂基因3
中国农业科学院博士学位论文第一章引言成功转入水稻中(Vainetal.,1998)。1999年,Maqbool等首次报道获得了转cry1Ac+cry2A双价基因水稻(MaqboolandChristou,1999)。我国的转基因抗虫水稻品系所用抗虫基因主要是Bt基因。1995年,浙江大学与加拿大渥太华大学合作,研发成功了能够稳定遗传的转cry1Ab基因水稻,对8种鳞翅目害虫具有良好的控制效果;1998年,我国农业部批准其进行环境释放试验,并命名为“克螟稻”(白耀宇等,2006)。华中农业大学将融合型Bt基因cry1Ab/1Ac基因导入明恢63恢复系,获得了对二化螟、三化螟和稻纵卷叶螟有较高抗性的“华恢1号”及“Bt汕优63”;随后,又成功将cry1Ac、cry1C、cry2A及cry9C基因分别转入明恢63中(Chenetal.,2005;陈浩,2005;Tangetal.,2006)。“华恢1号”及“Bt汕优63”两个品系在2009年首次获得了中国农业部颁发的商业化生产应用生物安全证书。1.2抗虫转基因作物风险评价程序目前应用较广的当属抗虫转基因作物。转入植物体内的杀虫基因主要有两类:一是从细菌中分离出的抗虫基因,如Bt毒蛋白基因;二是从植物体内分离出的抗虫基因,如胰蛋白酶抑制剂基因和雪花莲凝集素基因(Burgessetal.,1996;林良斌和官春云,1997;崔洪志和郭三堆,1998)。种植抗虫转基因作物会减少农药的使用对环境的破坏,但是也存在潜在的生态风险(Konrad,2008)。其中,研究对非靶标生物的潜在影响是抗虫转基因作物安全评价工作中非常重要的一环。评价非靶标影响首先要选择合适的受试生物,在田间具有重要生态功能的生物最有可能是研究对象,如天敌、传粉昆虫和具有降解作用的微生物等,选择受试生物时一般遵循以下3个原则:最有可能接触到转基因产物;有可能对转基因产物敏感;容易获得且易于人工控制(王园园等,2011;Romeisetal.,2013)。在研究抗虫转基因作物的非靶标影响时,一般采用分层次评价体系(Garcia-Alonsoetal.,2006;USEPA2007;Romeisetal.,2008a)。分层次评价体系主要包括实验室水平试验(lower-tier)到半田间水平试验(middle-tier),再到田间试验(higher-tier)(Romeisetal.,2011;王园园等,2011)。在实验室条件下评价转基因抗虫作物的非靶标效应,主要开展三类试验:1)Tier-1试验,即将高剂量的、纯化的、有活性的杀虫蛋白以人工饲料为载体或其它方式直接饲喂给受试生物,以检测Bt蛋白对受试生物的直接毒性(Romeisetal.,2004;Duanetal.,2008;Lietal.,2008);2)二级营养试验,对于可以直接取食植物组织(如花粉)的受试生物,可将转基因作物组织直接饲喂给受试生物的方式(Lietal.,2008;Wangetal.,2012);3)三级营养试验,主要用于研究转基因抗虫对捕食性和寄生性天敌的潜在影响,用转基因植物组织和纯杀虫蛋白饲喂受试生物的猎物或寄主,然后把含转基因杀虫蛋白的猎物或寄主饲喂受试生物(LiandRomeis,2010;Lietal.,2013a)。1.3抗虫转基因植物对蜜蜂类影响的研究进展1.3.1蜜蜂类昆虫概述蜜蜂类昆虫是农业生态系统中最重要的传粉昆虫之一,也是重要的经济昆虫,主要采集作4
中国农业科学院博士学位论文第一章引言物的花粉、花蜜或酯类物质作为食物,也可采集由蚜虫等昆虫吸食植物汁液后分泌的蜜露。经过蜜蜂授粉的农作物的产量会有所增加,产品质量也会得到改善(刘艳荷等,2001;Maloneetal.,2008;张金振等;2010;王瀛寰等,2012;杨俊,2012)。转基因植物产生的花粉、蜜露、酯类物质可能含有转入的基因片段或基因表达的产物,目前田间商业化种植的转基因大豆、玉米、油菜、马铃薯和棉花等要靠蜜蜂传粉或为蜜蜂提供大量花粉,在传粉过程中蜜蜂或其它传粉蜂很有可能会通过这种方式接触到转基因作物表达的基因产物,这可能会对田间蜜蜂等的种群和生物多样性产生影响(MaloneandPham-Deleguep,2001;Malone,2002;Duanetal.,2008)。蜜蜂的种类主要是西方蜜蜂如意大利蜜蜂(意蜂)(Apismelliferaligustica)和东方蜜蜂如中华蜜蜂(中蜂)(Apisceranacerana)(吴杰,2012)。在田间,蜜蜂可能会通过采集花粉和蜜露而接触转基因作物表达的产物,花粉可以为蜜蜂提供丰富的蛋白质,而花蜜的主要成份是糖类以及少量的蛋白质,但是目前还没有在植物蜜露中检测到转基因产物,所以花粉是蜜蜂接触转基因产物最重要的途径(Babendreieretal.,2005)。此外,有研究发现在蜂蜜中可以检测出完整的转基因DNA片段(张秀杰等,2010),这说明转基因作物的产物有可能出现在蜂蜜中。除蜜蜂之外,熊蜂(Bombusterrestris)和独栖蜂(Osmiabicornis)在缺少蜜蜂的地区和农田中也起到了关键性的传粉作用,例如番茄等温室植物靠熊蜂传粉的比例逐渐增加,而独栖蜂则可以为苜蓿、十字花科蔬菜、蓝莓、果树等传粉(WolfenbargerandPhifer,2000;BoschandVicens,2005;Boschetal.,2006;Babendreieretal.,2008,Whitehornetal.,2012)。因此,在转基因作物商业化推广之前开展对蜂类的安全性评估是非常必要的。在评价抗虫转基因作物对传粉蜂类的风险时,一般从杀虫蛋白对蜂类的生长发育、肠道微生物群落及蜜蜂行为的影响几个方面进行研究。1.3.2对生长发育影响的研究通过直接或间接的方式把转基因杀虫蛋白或转基因植物组织饲喂给受试生物,对比分析受试生物的不同生命表参数来评价转基因作物对受试生物的潜在影响。目前,已有大量关于转基因杀虫蛋白或转基因作物花粉对蜜蜂潜在影响的研究。1.3.2.1对蜂类成虫的潜在毒性研究蜜蜂工蜂在蜂群中担任酿蜜、调制蜂粮、泌蜡造脾饲喂蜂王及幼虫、采集花粉和花蜜等工作,其寿命因季节的不同而有所不同,在采集季节,其平均寿命为35天,但是越冬蜂通常能存活3-4个月(吴杰,2012)。转基因抗虫作物的种植使得蜜蜂工蜂有机会接触到杀虫蛋白。在转基因评价工作中,一般将蜜蜂的存活率、寿命、体重、食物消耗速度作为重要的试验参数。目前已有大量关于杀虫蛋白或转基因作物花粉对意大利蜜蜂及其它传粉蜂潜在影响的报道。Malone等先后将Cry1Ba蛋白分别按照不同浓度混入花粉中饲喂意大利蜜蜂工蜂成虫,结果没有发现对意蜂的存活率、寿命及食物消耗速度产生影响(Maloneetal.,1999,2001,2004)。Babendreier等研究了转cry1Ab基因玉米(MON810)及Cry1Ab纯蛋白对意大利蜜蜂的影响,未发现Bt花粉和纯蛋白对存活率有毒性影响(Babendreieretal.,2005)。Han等将转cry1Ac+CpTI棉花5
中国农业科学院博士学位论文第一章引言(CCRI41)花粉与水和蜂蜜按比例混匀后饲喂意大利蜜蜂,并没有发现含有Cry1Ac+CpTI蛋白的棉花花粉对意蜂成虫有致死的风险(Hanetal.,2010a,2012),Liu等将转cry1Ac基因棉SK-310花粉和转Bt+CpTI棉花粉按不同剂量混入蔗糖溶液中,研究了两种转基因棉花粉对意大利蜜蜂工蜂的影响,试验结果表明两种转基因棉的花粉对意蜂工蜂均没有急性经口毒性,对意蜂的寿命和死亡率也没有影响(Liuetal.,2005,2009)。Dai等将Cry1Ah蛋白加入到蔗糖溶液(60%w/v)中分别饲喂中华蜜蜂A.cerana和意大利蜜蜂,结果Cry1Ah蛋白处理的中蜂和意蜂存活率、寿命均没有受到影响,花粉消耗与对照也没有显著差异(Daietal.,2012a,b)。Rose等开展了实验室饲喂试验和大田试验研究转Cry1Ab基因玉米花粉对意大利蜜蜂成虫的影响,结果在实验室试验中用该转基因玉米花粉饲喂意蜂35天后蜜蜂体重和存活率与对照相比没有显著性差异;经过28天的田间试验也没有发现取食转基因玉米花粉后对蜜蜂生长发育影响(Roseetal.,2007)。蜜蜂工蜂在6日龄时王浆腺体开始发育,10日龄时王浆腺腺泡直径达到最大,王浆腺重量在第12日时最大(Maloneetal.,2004;吴杰,2012;Daietal.,2012a)。在研究对蜜蜂毒性影响时,王浆腺发育情况也是研究重要方面之一。Malone等研究没有发现Cry1Ba蛋白对意蜂的王浆腺腺泡直径、腺体重量及腺体内蛋白含量有任何影响(Maloneetal.,2004)。Babendreier等研究分别取食转cry1Ab基因玉米、Cry1Ab纯蛋白及大豆胰蛋白酶抑制剂(SBTI)10天的意大利蜜蜂王浆腺发育情况,结果显示:虽然在蜜蜂成虫王浆腺中检测出少量的Bt蛋白,但Bt玉米花粉和Bt纯蛋白对意蜂成虫王浆腺的发育均没有影响;相反取食了SBTI的意蜂王浆腺平均重量,王浆腺腺泡平均直径均明显变小,但在蜜蜂王浆腺中并没有检测出SBTI(Babendreieretal.,2005)。Dai等的研究也没有发现Cry1Ah对12日龄中华蜜蜂和意大利蜜蜂王浆腺产生影响(Daietal.,2012a)。为了评估抗虫转基因植物对熊蜂的潜在风险,Babendreier等将杀虫蛋白(Cry1Ab毒素、SBTI、GNA)溶入到蔗糖溶液中与花粉共同饲喂熊蜂80天,结果并没有发现Cry1Ab蛋白对熊蜂寿命等有影响,而取食了SBTI和GNA的熊蜂死亡数明显增加,产生的后代数量显著减少(Babendreieretal.,2008)。1.3.2.2对幼虫的潜在毒性研究一般来说,蜜蜂工蜂幼虫在1-3日龄时以蜂王浆为食,随后发育过程中其食物为加入了少量花粉且多蛋白少糖的王浆,并且幼虫没有能力选择自己的食物,以致于蜜蜂工蜂幼虫在发育阶段有机会持续地接触到转基因植物花粉中的转基因成份(vanderSteenetal.,2001;吴杰,2012)。Babendreier等在田间网室内饲养一小群意大利蜜蜂幼虫,只利用开花期玉米植株为蜜蜂提供花粉作为蛋白质源。将生长完全的工蜂幼虫解剖后发现幼虫排便前其肠道内含有1720-2310粒玉米花粉粒,相当于平均每头幼虫消耗1.52-2.04mg花粉。其中74.5%的花粉粒被完全消化,23.3%部分消化,只有2.2%没有被消化。这一数据说明蜜蜂幼虫通过花粉直接取食的蛋白质占其整个幼虫生长发育阶段需要蛋白质总量的5%左右(Babendreieretal.,2004)。因此,在评估抗虫转基因植物的环境风险时,对蜜蜂幼虫的潜在影响也应考虑在内。近些年来关于转基因作物对蜜蜂幼虫影响的研究在逐渐增加。但是在评估转基因植物对蜜蜂幼虫风险之前,首要任务是要解决蜜蜂幼虫体外(invitro)饲养的问题,目前已经有人发展出在实验室条件下饲养西方蜜蜂幼虫的方法,并改良了蜜蜂幼虫人工饲料配方(Brødsgaardetal.,6
中国农业科学院博士学位论文第一章引言2003;Silvaetal.,2009;Hendriksmaetal.,2011a),这也为今后对蜜蜂幼虫的风险评估工作奠定了基础。一些科研工作者已将Bt蛋白或转基因作物花粉加入到半人工饲料中评价Bt蛋白对蜜蜂的毒性。Hendriksma等将表达Cry1Ab蛋白的转基因玉米DKc7565、表达2种抗虫基因和一种耐除草剂基因的转基因玉米Mon89034*Mon88017等花粉及GNA、Cry1A、Cry2Ab2、Cry3Bb1等添加到半人工饲料中,分别饲喂意大利蜜蜂幼虫至化蛹。结果没有发现任何转基因成份对幼虫存活率及蛹重产生影响(Hendriksmaetal.,2011b,2012)。Lima等将以高浓度的Cry1Ac连续饲喂西方蜜蜂幼虫5天,结果显示幼虫存活率、发育时间、羽化后成虫体重和大小均没有受到影响。这说明转cry1Ac基因棉花影响蜜蜂幼虫生长发育的可能性极小(Limaetal.,2011)。在缺乏合适的蜜蜂幼虫人工饲料及饲养方式时,田岩等将转cry1Ac棉花和转cry1Ab玉米花粉放在蜂巢中利用哺育蜂将花粉传递给幼虫并观察意蜂幼虫的生长发育,结果显示:在Bt花粉处理的6日龄意蜂幼虫体内均检测出Bt蛋白;取食Bt花粉和非Bt花粉的幼虫和蛹发育历期以及4、5、6日龄幼虫体重均没有显著差异(田岩等,2006a,b)。代平礼等给意大利蜜蜂蜂群中4-6日龄幼虫分别饲喂转cry1Ah玉米花粉,实验结果显示未成熟期幼虫存活率、封盖率、出房率及发育历期均不受影响(代平礼等,2012)。除了Bt蛋白及其转基因作物,其它杀虫蛋白如GNA,SBTI等对蜂类幼虫的毒性影响也是研究者们所关注的焦点。Brodsgaard等将SBTI分别按0.1%和1.0%(w:w)加入半人工饲料中饲喂意大利蜜蜂幼虫至成虫,结果发现,高剂量SBTI使幼虫生长发育显著减慢,死亡率明显上升,羽化的成虫体重显著减轻;但低剂量SBTI对蜜蜂幼虫生长发育并没有不利影响(Brødsgaardetal.,2001)。Lerman等将两种转豌豆凝集素基因(PSL)油菜(T-17和T-132)与人工饲料按比例混合后饲喂西方蜜蜂幼虫。试验结果显示幼虫发育时间有所减少、体重显著增加,但三个花粉处理之间并没有显著性差异(Lehrman,2007)。Konrad等研究了表达半胱氨酸蛋白酶抑制剂(OC-1)的转基因油菜花粉对独栖蜂O.bicornis的影响,将转OC-1油菜花粉和分别添加了rOC-1、Cry1Ab和GNA的花粉喂养独居蜂幼虫,结果转OC-1油菜花粉对蜂幼虫生长发育没有不利影响,含高剂量rOC-1、Cry1Ab蛋白和低剂量GNA的花粉处理的幼虫与对照相比生长发育也没有显著性差异;但是含高剂量GNA的花粉显著延长了幼虫发育时间,也明显减少了幼虫体重(Konradetal.,2008)。Malone等研究了不同浓度的胰蛋白酶抑制剂SBTI,牛胰蛋白酶抑制剂BPTI和两种土豆蛋白酶抑制剂POT-1,POT-2对熊蜂的毒性影响。发现取食了高浓度的SBTI、POT-1和POT-2后,熊蜂的存活率明显下降,而BPTI对熊蜂存活率无明显影响(Maloneetal.,2000)。Duan等对25个Bt蛋白对蜜蜂存活率的影响的研究进行了分析,结果显示,在实验室水平上,已经商业化的转基因作物所表达的Cry蛋白如Cry1A、Cry1F、Cry1Ba、Cry2A、Cry3A、Cry3B、Cry9C等,对意大利蜜蜂幼虫和成虫存活不产生影响(Duanetal.,2008)。1.3.3对中肠酶活性影响的研究中肠内分泌有多种蛋白酶和解毒酶,是昆虫消化吸收的主要场所,也是杀虫蛋白的作用部位。Bt蛋白进入昆虫肠道后,在蛋白酶作用下,原毒素被活化后使中肠膜细胞渗透压发生变7
中国农业科学院博士学位论文第一章引言化,引起穿孔,最终导致昆虫死亡。有研究表明,昆虫中肠蛋白酶的活性产生变化可能会直接影响原毒素的活化速度,因此中肠蛋白酶的活性与Bt蛋白对昆虫的毒性密不可分,如氨肽酶是首个被报道的在Bt杀虫机制中起作用的毒素受体蛋白质,解毒酶在分解外源毒素过程中起重要作用(Oppertetal.,1996;Gunning,2005;Yang,2009)。也有研究表明,昆虫取食Bt蛋白后可能会引起体内保护酶如过氧化物酶(POD)、超氧化物歧化酶(SOD)等活性发生变化(蒋晴等,2013)。因此,了解肠道内各种相关蛋白酶或解毒酶的活性变化,也是研究杀虫蛋白或转基因作物对昆虫毒性影响的重要方面。Malone等将两种土豆蛋白酶抑制剂POT-1和POT-2分别加入糖水和花粉中饲喂意大利蜜蜂3天和8天,结果发现胰蛋白酶、胰凝乳蛋白酶和胰肽酶和氨肽酶的活性在蜜蜂取食了高浓度的POT-1和POT-2后均明显降低,而低浓度的POT-1和POT-2不对这几种酶产生影响(Maloneetal.,1998)。Han等研究发现转cry1Ac+CpTI棉花花粉对意蜂中肠的蛋白水解酶活性没有影响(Hanetal.,2010a,2012)。Liu等没有发现转cry1Ac基因棉花和转Bt+CpTI棉花花粉对意蜂工蜂体内的SOD活性产生影响(Liuetal.,2005,2009)。田岩等分别将转cry1Ac棉花和转cry1Ab玉米花粉饲喂给幼虫,发现取食Bt花粉后意蜂幼虫体内α-乙酸萘酯酯酶(α-NAE)活性明显升高,强碱、弱碱性胰蛋白酶性显著降低,但是取食转cry1Ac棉花花粉的幼虫体内乙酰胆碱酯酶活性极显著高于对照而取食转cry1Ab玉米花粉的幼虫该酶活性则极显著低于对照(田岩等,2006a,b)。这些研究表明,在取食了蛋白酶抑制剂或转基因抗虫作物花粉后,意大利蜜蜂体内蛋白酶和解毒酶活性可能会受到一定程度的影响。因此,在今后的转基因作物风险评估过程中,应该重视转基因成份对昆虫肠道相关酶活性的研究。1.3.4对肠道微生物影响的研究经过长期的进化,昆虫与其体内微生物已经建立了密切的联系,蜜蜂消化系统是微生物的一个重要的栖息地(相辉等,2007),细菌群落也可以从个体水平和整体水平上反应蜜蜂的健康状况(MohrandTebbe,2006;Babendreieretal.,2007)。因此,在评价转基因作物和杀虫蛋白对蜜蜂的安全性时,除了测定蜜蜂存活率、酶活性及王浆腺的发育程度以外,蜜蜂消化道内微生物群落也是一个重要方面(Babendreieretal.,2007)。大部分研究主要集中在蜜蜂的致病性微生物的方面,也有一些人对蜜蜂肠道内非病原性微生物群落(如共生菌等)及其对蜜蜂生长发育的潜在影响进行了研究,这也说明了人们越来越关注肠道微生物对蜜蜂种群的重要性(Alippietal.,2002;DillonandDillon,2004;Martinsonetal.,2012;Moranetal.,2012;Vojvodicetal.,2013)。目前已有不少研究从分子生物学角度分析取食了转基因作物或杀虫蛋白的蜜蜂肠道微生物群落结构,研究中应用较多的技术有分子标记技术RFLP(限制性片段长度多态性)及PCR-DGGE图谱分析技术等(姜玮瑜等,2010;崔红娟,2011;Disayathanoowatetal.,2012)。Babendreier等利用分子标记技术T-RFLP和PCR技术分析了意蜂肠道微生物16SrRNA片段及末端限制性片段(T-RFs),结果发现取食转cry1Ab基因玉米花粉和高浓度Cry1Ab蛋白的意蜂肠道微生物群落并没有受到影响,只有取食了高浓度SBTI的意蜂中肠内T-RFs数量显著减少,并引起蜜蜂的大量死亡。并得出总的细菌群落结构在亚致死水平上评估杀虫蛋白对蜜蜂的影响方面并8
中国农业科学院博士学位论文第一章引言不是一个敏感的指标的结论(Babendreieretal.,2007)。Hendriksma等利用T-RFLP技术研究了转基因玉米对意蜂肠道菌群的影响,没有发现Bt玉米花粉中所表达的Cry1A.105、Cry2Ab2、Cry3Bb1蛋白对哺育蜂肠道细菌群落结构有影响(Hendriksmaetal.,2013)。姜玮瑜等研究了在自然条件和人为高选择压力下转cry1Ac基因棉(SGK321)和Cry1Ah蛋白对意大利蜜蜂和中华蜜蜂肠道细菌群落的影响,通过DEEG图谱分析并没有发现不同处理之间细菌群落组成有明显差异,且PCR方法也没有检测到外源DNA整合到蜜蜂肠道微生物的基因组中(姜玮瑜等,2010;Jiangetal.,2013)。1.3.5对蜜蜂行为的影响蜜蜂的采集行为和学习行为都可能直接或间接地影响蜜蜂种群的发育及给农作物的授粉,尤其是在采粉初期是非常重要的。蜜蜂工蜂的取食行为可关系到幼虫及蜂王的饲喂。因此,研究转基因作物的种植是否会对蜜蜂的学习行为、采集行为及取食行为产生影响也是转基因作物风险评价过程中的重要一环。在研究蜜蜂嗅觉学习行为时,一般采用测吻伸率的方法(Decourtyeetal.,2001)。代平礼等研究了Cry1Ah毒素对意大利蜜蜂吻伸行为的影响,发现高剂量Cry1Ah蛋白处理的蜜蜂对30%蔗糖溶液的吻伸行为显著低于纯糖水处理,而低浓度处理组与对照没有明显差异。随后又在大田网室中研究了转cry1Ah基因玉米对意蜂行为的影响,结果显示Bt玉米和非Bt玉米间意蜂工蜂群的采集行为(携粉率、采集花粉重量及采集蜂体重)没有显著性差异,且吻伸试验也没有发现转基因玉米对意蜂嗅觉学习行为有影响(代平礼,2011)。Han等将转cry1Ac+CpTI棉花(CCRI41)花粉与蜂蜜混合后喂养西方蜜蜂7天,发现转基因棉花花粉处理的蜜蜂取食行为受到影响,该组蜜蜂消耗的花粉量明显比非转基因棉花粉组减少(Hanetal.,2010a)。但是在随后的实验中,Han等分别对蜜蜂的视觉和嗅觉学习行为进行观察,没有发现CCRI41花粉对蜜蜂学习能力有影响(Hanetal.,2010b)。Ramirez-Romero等给新羽化的蜜蜂成虫喂食含不同浓度Cry1Ab纯蛋白的饲料后,发现在摄取了高浓度Cry1Ab蛋白之后,蜜蜂的取食行为受到影响,与对照相比需要消耗更长的时间吸入食物;其学习行为也被干扰,表现为在第5次试验后蜜蜂吻伸反应数明显减少(Ramirez-Romeroetal.,2008)。Grallien等在人工气候室中种植转水稻巯基蛋白酶抵制剂基因(OCI)油菜和相应非转基因油菜,待油菜花期将一小蜂群放到气候室中观察后,结果发现蜜蜂在两种油菜上的采集行为并没有明显差别,总的停留时间和在每朵花上平均时间也均没有显著性差异,而且蜜蜂在转基因油菜上的搜寻频率要高于非转基因油菜(Grallienetal.,1995)。除了以上的直接影响外,外源基因在植物体内的表达可能会造成间接影响,如改变转基因植物的表型,插入突变有可能导致植物不能开花等,从而减少对蜜蜂的吸引力和蜂产品的营养价值,并已有报道指出转基因油菜表型的变化影响了蜜蜂的采集行为(Burgessetal.,1996;Maloneetal.,2008)。9
中国农业科学院博士学位论文第一章引言1.4研究背景、内容及意义1.4.1研究背景蜜蜂等传粉蜂类在农田生态系统中具有重要的生态功能和经济功能,其在采集花粉和传粉过程中很有可能会接触到杀虫蛋白,因此抗虫转基因作物的种植对传粉蜂类的潜在风险已引起国内外专家的高度关注。大量研究表明抗虫转基因作物对蜜蜂等生长发育并没有产生影响(Duanetal.,2008),但也有研究指出高剂量的杀虫蛋白会干扰蜜蜂的学习行为等(代平礼,2011)。在农田中,抗虫转基因作物体内杀虫蛋白的表达量很小,因此蜜蜂通过花粉接触到高剂量杀虫蛋白的机会极低。虽然目前已有大量研究针对抗虫转基因作物对传粉蜂类的风险展开,主要集中在对成虫的研究,而对幼虫研究较少。因此,在得出最后结论之前还需要大量工作来研究抗虫转基因作物对蜜蜂的安全性。水稻是重要的粮食作物,转基因抗虫水稻对出现直接与人类生活息息相关,其安全性深受人们关注。开展转基因抗虫水稻安全性研究势在必行。有大量研究表明,水稻在盛花期可以为意大利蜜蜂提供大量花粉作为食物(徐景耀,1980;赖友胜等,1985;余玉生等,1999;沈育初,2002;王丽华等,2005;刘家富,2013)。因此,研究转基因抗虫水稻对意大利蜜蜂的潜在毒性是转基因抗虫水稻风险评估过程中不可忽略的一部分。1.4.2研究内容本文主要在实验室水平上,从不同角度系统地研究了两种转基因抗虫水稻品系T2A-1和T1C-19对意大利蜜蜂幼虫及成虫的潜在毒性影响。研究内容主要包括:(1)基于国际上报道的意大利蜜蜂幼虫人工饲料,发展了一种简单灵敏的检测胃毒性杀虫剂或转基因杀虫蛋白对意大利蜜蜂幼虫直接毒性影响的检测方法。(2)利用所建立的方法,分别从生物学、生理生化、组织病理学等手段系统地研究评价了Cry2A、Cry1C蛋白及相应的抗虫水稻花粉对意大利蜜蜂幼虫的毒性影响。(3)通过直接饲喂的方式,研究了Cry2A、Cry1C蛋白及相应的抗虫水稻花粉对意大利蜜蜂成虫的潜在毒性。1.4.3研究意义本研究以转cry2A基因的T2A-1和转cry1C基因的T1C-19及其亲本明恢63为材料,建立评价转基因抗虫作物对意大利蜜蜂潜在影响的技术体系。在实验室水平上系统地评价T2A-1及T1C-19水稻对意大利蜜蜂的潜在影响,该研究结果将为我国转基因抗虫水稻在我国的产业化决策及安全管理提供科学依据。10
中国农业科学院博士学位论文第二章Bt蛋白对意大利蜜蜂幼虫的潜在影响第二章Bt蛋白对意大利蜜蜂幼虫的潜在影响蜜蜂是一种重要的经济和社会性昆虫(吴杰,2012)。蜜蜂靠采集花蜜和花粉生存繁衍,客观上起到为植物授粉,促进自然生态平衡发展的作用,对自然界贡献巨大,是人类以及其他生物所无法比拟的。蜜蜂如意大利蜜蜂以植物花粉为主要蛋白来源,同时也采集植物花蜜和蚜虫或其它昆虫分泌的蜜露(Malone,2002)。这样,取食过程中可能暴露于杀虫剂或转基因抗虫植物表达的外源杀虫蛋白,如Bt蛋白。取食转基因抗虫植物花粉可能是蜜蜂暴露于转基因外源杀虫蛋白的唯一途径,因为目前还未发现植物花蜜或昆虫蜜露中存在转基因杀虫蛋白。另外,蜜蜂对毒性化合物较为敏感,一直作为重要的指示性物种被用于杀虫剂和转基因抗虫植物环境安全评估中(BakerandBaker,1986;Crailsheim,1990;Maloneetal.,2001;Babendreieretal.,2004,2005;Henryetal.,2012;Mommaertsetal.,2010;Stokstadetal.,2012;宋怀磊等,2011)。由于一度缺乏合适的蜜蜂幼虫人工饲料和饲养方法,相关评价工作中,传统上只采用蜜蜂工蜂成虫作为受试昆虫。然而,由于蜜蜂幼虫相对成虫对毒性化合物可能更加敏感,这样采用蜜蜂幼虫为受试生物更能反映出杀虫剂或转基因杀虫蛋白的潜在毒性。因此,近年国际上推荐把蜜蜂幼虫作为杀虫剂和转基因抗虫作物安全性评价的指示性生物(Hendriksmaetal.,2011a)。基于上述情况,本研究基于国际上最近报道的意大利蜜蜂幼虫人工饲料,发展了一种简单灵敏的评价胃毒性杀虫剂或转基因杀虫蛋白对意大利蜜蜂幼虫直接毒性影响的试验体系,并采用大豆胰蛋白酶抑制剂SBTI为阳性化合物验证了该试验体系的有效性和敏感性。利用所建立的试验体系,系统地评价了已转入水稻的cry1C和cry2A基因表达的蛋白对意大利蜜蜂幼虫的潜在影响。2.1材料和方法2.1.1供试昆虫意大利蜜蜂由中国农业科学院蜜蜂研究所提供。试验中所用幼虫取自三个蜂群。在继箱中(45×55×65cm)放入一张空脾,将蜂王放入该继箱中24小时,让其产卵。待卵孵化后第二天,用移虫针从巢脾中取出2日龄幼虫用于试验。Bt敏感品系二化螟幼虫取自本实验室利用人工饲料继代培养超过50代的群体。二化螟初孵幼虫(<12h)用于试验。2.1.2供试试剂高活性纯鲜王浆购于北京金蜂王蜜蜂产品研究所,酵母浸提物购买于OxoidLtd.(Hampshire,England),D(+)葡萄糖、D(+)果糖、BSA、SBTI均购于Sigma-Aldrich(St.Louis,MO,USA)。Cry1C和Cry2A纯蛋白及相应的ELISA试剂盒均购于Envirotest-China(agentforEnvirologixInc.,Portland,Maine,USA;www.envirotestchina.com)。Cry1C和Cry2A纯蛋白纯度为94-96%。这两种11
中国农业科学院博士学位论文第二章Bt蛋白对意大利蜜蜂幼虫的潜在影响Cry蛋白的生物活性通过敏感昆虫生测试验测定,Cry1C蛋白的EC50为18.1ng/mL,Cry2A蛋白EC50为1310.3ng/mL。酶活测定试剂盒购于北京绿源博德生物技术有限公司。2.1.3主要仪器人工气候箱(RXZ-380a),恒温培养振荡器(ZHWY-200D),GL-802A型微型台式真空泵,超纯水仪(UltraGenetic),生物学显微镜(Olympus,BX63),镜头(Olympus,DP73),离心机(Eppendorf,Centrifuge5415R,5418)、酶标仪(PowerWaveXS2,BioTek)、电子天平(Sartorius,CPA225D,d=0.01mg),体式镜(SZX7,Olympus),涡旋仪(IKAMS3,Eppendorf),组织研磨器(G20,Coyotebio,r=1200rpm)。2.2试验内容2.2.1意大利蜜蜂幼虫人工饲料制备建立评价胃毒性杀虫剂或转基因杀虫蛋白对意大利蜜蜂幼虫潜在毒性影响的试验体系,首先需要一个合适的蜜蜂幼虫人工饲料。本体系采用的蜜蜂幼虫人工饲料主要成份如表2.1。配制100g人工饲料具体方法如下:(1)分别称取8g果糖、4g葡萄糖和1g酵母置于烧杯A中,称取50g蜂王浆置于烧杯B中;(2)将去离子水(ddH2O)煮沸,待冷却至50ºC左右时称取37g加入到烧杯A中,用玻璃棒充分搅拌,使各成份完全溶解;(3)将烧杯A中的溶液轻轻倒入烧杯B中,充分搅拌均匀,然后分装在5mL离心管中,并置于-20°C冰箱保存直至使用。若要加入杀虫化合物,则在步骤2去离子水冷却后,将杀虫化合物按照比例溶解在去离子水中,其它步骤不变。表2.1意大利蜜蜂幼虫人工饲料配方Table2.1FormulationsofartificialdietofA.melliferaligusticalarvae成份比例(%)蜂王浆50去离子水37D(+)-果糖8D(+)-葡萄糖4酵母粉112
中国农业科学院博士学位论文第二章Bt蛋白对意大利蜜蜂幼虫的潜在影响2.2.2意蜂幼虫人工饲养方法具体操作过程如下:(1)受试幼虫准备:在蜂巢中将蜂王控制在一张空巢脾上产卵24小时后转移蜂王,避免蜂王在该巢脾上继续产卵;(2)用移虫针将1.5-2d龄幼虫轻轻转入24孔细胞培养皿的孔穴中,每孔1头幼虫,该过程中要避免碰到幼虫体表而伤害幼虫。然后利用移液枪小心地将液态人工饲料,加到幼虫周围,使虫体漂浮在饲料上,避免将人工饲料直接洒到虫体上而使其窒息死亡。饲料每天更换,试验开始第一和第二天每天每头幼虫提供100µL饲料,以后每头幼虫每天200µL饲料。换饲料时利用真空泵小心将虫体周围剩余的饲料吸干净后加入新的饲料;(3)当发现虫体周围出现黄色晶体或脂肪体说明幼虫进入排便阶段,幼虫期结束,幼虫老熟,即将进入预蛹期。将老熟幼虫用镊子取出置于吸水纸上,轻轻地翻滚虫体,吸除虫体表面沾有的饲料。称重后转移到新的、孔穴底部垫有滤纸的24孔细胞培养皿中,继续观察,直至羽化。对新羽化蜜蜂成虫进行称重;(4)试验在人工气候箱中进行,温度为34°C,无光照,幼虫阶段的相对湿度为90%,预蛹至成虫羽化的相对湿度为70%,每个试验处理设3-5个重复,每个重复15-24头幼虫。(5)试验过程中每12小时观察一次受试蜜蜂,记录幼虫死亡率、发育历期、老熟幼虫体重、成虫羽化率及新羽化成虫体重这些生命表参数。2.2.3蜜蜂幼虫取食不同浓度SBTI的生物学反应由于前人研究证明SBTI对意蜂有毒,因此本研究采用SBTI作为阳性化合物检测上述人工饲料是否适合用于研究杀虫化合物对意蜂幼虫的潜在毒性。将大豆胰蛋白酶抑制剂SBTI按以下浓度均匀加入人工饲料中:0.1mg/gFW,1mg/gFW,10mg/gFW,纯人工饲料为空白对照,配制方法如2.2.1所述。每个处理设3个重复,每个重复24头幼虫。按照上述方法饲喂意大利蜜蜂工蜂幼虫,研究不同浓度SBTI对意蜂工蜂幼虫生命表参数的影响。每天检查两次幼虫发育情况(9:00am;9:00pm),记录死亡个数,并称量老熟幼虫和新羽化成虫体重。2.2.4Bt蛋白对蜜蜂幼虫的毒性影响2.2.4.1蜜蜂幼虫生命表参数观察试验共设5个处理:(1)纯人工饲料(空白对照),饲料不加任何其它化合物;(2)含Cry1C蛋白的饲料,浓度为50µg/gFW;(3)含Cry2A的饲料,浓度为400µg/gFW;(4)含BSA的饲料作为阴性对照,浓度为400µg/gFW;(5)混入SBTI的人工饲料(阳性对照),浓度为1mg/gFW。饲料配制如2.2.1所述,并按照2.2.2所述饲喂方法进行试验。每个处理共有5个重复,每个重复15头幼虫。每天检查两次幼虫发育情况(9:00am;9:0013
中国农业科学院博士学位论文第二章Bt蛋白对意大利蜜蜂幼虫的潜在影响pm),记录死亡个数,并称量老熟幼虫和新羽化成虫体重。2.2.4.2蜜蜂幼虫Bt蛋白摄取量检测采用2.2.2所述方法,用分别含Cry1C(50µg/gFW)、Cry2A(400µg/gFW)的人工饲料和纯人工饲料饲喂蜜蜂幼虫,分别取6头取食饲料2天和4天的幼虫及新形成的蛹用于ELISA检测,每头幼虫或蛹作为一个样品。所取样品放在-20ºC冰箱保存。ELISA试验具体步骤如下:(1)试验之前先用PBS缓冲液将虫体表面残留的饲料清洗干净。(2)用电子天平称量各样品重量。(3)按1:4比例用ddH2O稀释试剂盒中提供的Cry1C(Cry2A)提取液。每个样品中加入1mL配好的提取液,用自动研磨器将组织打碎。(4)将样品在4ºC离心机中以13000rpm离心5分钟,提取上清液用于测定试验。(5)点样前,将样品稀释至合适的浓度。(6)将Cry1C50µL标准品(Cry2A:100µL)和待测样品点在点样孔中,将酶标板在桌面上轻轻地左右摇晃,使用封口膜将板封住,室温下静置15min。(7)向点样孔中加入50µLCry1CEnzymeConjugate(Cry2A:100µL),混匀后封口膜封住,在常温下放置1h。(8)洗板。用PBST清洗点样孔3次,然后在吸水纸上用力拍打,将水拍干。(9)加底物。在每个孔中加入100µL底物。室温放置30min。(10)加终止液。每个孔中加入100µl终止液。在酶标仪上读板,测定450nm处的吸光值,30min内完成。(11)记录数据,绘制标准曲线,计算样品中Cry1C(Cry2A)蛋白浓度。2.2.4.3Cry蛋白的生物活性检测敏感昆虫生测试验用于检测意蜂幼虫人工饲料中Cry蛋白的生物活性。取一定量新鲜的分别含有Cry2A和Cry1C蛋白的意蜂幼虫饲料及纯幼虫饲料,用提取液提取出相应的Cry蛋白,通过ELISA试验检测出Cry蛋白的浓度。然后按照EC50加入到二化螟人工饲料中混匀,然后将处理过的二化螟饲料切成2mm的薄片放在塑料培养皿(直径6cm,高1cm)中,后将二化螟初孵幼虫接到饲料上,用医用胶带将培养皿密封好,放在培养箱中,饲养条件为25ºC,RH70%,光周期为16L:8D。饲喂7天后,称量二化螟体重。每个处理30头二化螟。2.2.4.4取食Cry蛋白对蜜蜂幼虫消化道酶活性影响试验共设5个处理:1)纯人工饲料(空白对照),饲料不加任何其它化合物;2)含Cry1C蛋白的饲料,浓度为50µg/gFW;3)含Cry2A的饲料,浓度为400μg/gFW;4)含BSA的饲料作为阴性对照,浓度为400µg/gFW;5)含SBTI的人工饲料(阳性对照),浓度为1mg/gFW。按照2.2.2所述方法进行饲喂意蜂幼虫,4天后取样。在冰浴上用昆虫针将虫体两端固定住,腹面朝上,用解剖剪从尾部向头部剪开,并用镊子14
中国农业科学院博士学位论文第二章Bt蛋白对意大利蜜蜂幼虫的潜在影响将肠道取出,放在1.5mL离心管中,每个处理取7头虫子,每1头为一个重复。使用前将样品保存在-20ºC冰箱中。测定酶活性时,将样品取出后解冻,在每个离心管中加入300μL预冷的浓度为0.9%NaCl溶液,用自动研磨器进行研磨,将组织粉碎。然后将样品放在4ºC离心机中以3000rpm离心10分钟,取上清液进行试验。为避免样品反复冻融,将样品上清液分装后保存在-20ºC冰箱中。试验共测定4种酶的活性:总蛋白酶,类胰蛋白酶,氨肽酶和α-乙酸萘酯酯酶。测定方法按照试剂盒说明书进行操作,具体步骤如下:(1)试剂盒和待测样品从冰箱中取出,在室温下放置20分钟。(2)将试剂盒给出的20×洗涤缓冲液按照1:20的比例用去离子水稀释好,备用。(3)在标准品孔中加入不同浓度的标准品各50μL,S0,S1,S2,S3,S4,S5。(4)在样品孔按顺序加入待测样品各10μL,然后在各样品孔中加入样本稀释液40µL。(5)在标准品孔和样本孔中加入由辣根过氧化物酶(HRP)标记的检测抗体,各孔加100µL。用封口膜将板封住后,放在37ºC恒温摇床1h。(6)用洗涤液洗板,每孔加350µL后静置1min,甩去洗涤液,在吸水纸上用力拍干。重复洗板5次。(7)每个孔中加入底物A、B各50µL,放在37ºC恒温摇床避光孵育15min。(8)每个孔中加入50µL终止液,在酶标仪上读板,450nm波长处测定OD值,15min内完成。(9)绘制标准曲线,计算各样品酶活性。2.2.4.5组织病理学试验试验设有5个处理:1)纯人工饲料;2)含Cry1C蛋白的饲料,浓度为50µg/gFW;3)含Cry2A的饲料,浓度为400µg/gFW;4)含BSA的饲料,浓度为400µg/gFW;5)含SBTI的人工饲料,浓度为1mg/gFW。按照2.2.2所述方法饲喂意蜂幼虫。4天后,按照2.2.4.5所述方法将幼虫解剖,肠道取出后立即放入10%的中性甲醛中固定,放在4ºC至少24h。然后进行HE染色,具体步骤如下:(1)使用德国徕卡公司R2235切片机将肠道横切,切片厚度为4µm;(2)在60ºC下烘片1h,后用二甲苯脱蜡,然后在酒精中脱水,(3)用苏木精染色2min后水洗,然后用分化液分化,返蓝液进行返蓝;(4)用伊红染色1min,后水洗;(5)用低浓度酒精至高浓度酒精依次进行脱水,酒精浓度分别为70%,80%,90%,95%,100%酒精,每个梯度进行约2分钟,(6)然后用二甲苯脱色10min;(7)用树胶封片,将材料周围擦拭干净后滴1~2滴中性树胶,盖上盖玻片;(8)镜检。将做好的玻片在显微镜下进行观察,并利用数码成像系统拍照。15
中国农业科学院博士学位论文第二章Bt蛋白对意大利蜜蜂幼虫的潜在影响2.3数据分析幼虫发育到蛹和成虫的时间、老熟幼虫体重、新羽化成虫体重、化蛹率、羽化率均用Dunnett"stest检测。二化螟幼虫体重用Student’st-test分析。所有数据均利用SPSS(version13,2004)进行分析。2.4结果与分析2.4.1蜜蜂幼虫对SBTI的剂量反应试验结果显示:取食对照饲料,95%以上的幼虫发育成蛹(图2.1A),90%以上羽化成成虫(图2.1B)。随着人工饲料中SBTI浓度的提高,意大利蜜蜂幼虫的存活率逐渐降低(图2.1)。当饲料中SBTI浓度达到10mg/g时,没有幼虫能成功化蛹。取食了含有浓度为0.1mg/gSBTI的饲料后,幼虫发育到蛹和成虫的时间、老熟幼虫体重与取食对照饲料的蜜蜂幼虫相比没有显著性差异(Dunnett"stest;P>0.05)(图2.1A-D)。而SBTI浓度为1.0mg/g饲料时,意大利蜜蜂幼虫的化蛹率(Dunnett’stest;P=0.006)、羽化率(Dunnett’stest;P=0.0012)、老熟幼虫体重(Dunnett’stest;P=0.003)均明显下降,且幼虫发育为老熟幼虫的时间也显著延长(Dunnett’stest;P=0.023)(图2.1C)。2.4.2Bt蛋白对蜜蜂幼虫的毒性2.4.2.1生命表参数影响与纯人工饲料处理相比,取食了含有BSA、Cry1C、Cry2A蛋白的饲料意蜂幼虫的化蛹率、羽化率、发育到老熟幼虫的时间、羽化历期、老熟幼虫体重和新羽化成虫体重均没有显著差异(Dunnett’stest;P>0.05)(表2.2)。取食含SBTI的人工饲料,意蜂幼虫化蛹率、羽化率和发育历期(发育到老熟幼虫及成虫的时间)没有受到显著影响(Dunnett’stest;P>0.05)(表2.2),然而,老熟幼虫和新羽化成虫的体重与对照处理相比显著下降(Dunnett’stest;P<0.001)(表2.2)。2.4.2.2蜜蜂幼虫Bt蛋白的摄取量ELISA结果显示:取食含Cry1C和Cry2A蛋白人工饲料的幼虫发育成的蛹中并没有检测到Cry蛋白。在Cry1C处理中,取食2天和4天人工饲料后,幼虫体内Cry1C蛋白含量分别为0.61±0.04µg/gFW和0.82±0.14µg/gFW。取食含Cry2A人工饲料2天和4天后,Cry2A蛋白含量分别为29.11±2.01µg/gFW和18.70±1.02µg/gFW。16
中国农业科学院博士学位论文第二章Bt蛋白对意大利蜜蜂幼虫的潜在影响图2.1取食含不同浓度SBTI人工饲料的意大利蜜蜂幼虫的生命表参数Figure2.1SurvivalofA.melliferaligusticalarvaewhenfedanartificialdietcontainingdifferentconcentrationsofSBTI注:1)图中数值为平均值+标准误,n=3。2)*为显著差异P<0.05,Dunnetttest。17
1的人工饲料为阳性对照,浓度为SBTI蛋白对意大利蜜蜂幼虫的潜在影响SBTI77.33±9.0968.00±7.126.20±0.1218.96±0.20151.43±9.31*101.80±5.41*;混入µg/gFW400Cry1C89.33±1.6385.33±3.276.08±0.0518.46±0.10197.15±3.65134.39±2.84的饲料作为阴性对照,浓度为BSA;含Cry2A92.00±3.8986.67±4.716.06±0.0718.59±0.05190.70±5.39131.17±4.96workerlarvaefedartificialdietcontainingdifferentcompounds400µg/gFWligustica的饲料,浓度为BSA92.00±3.2790.67±3.405.98±0.2018.66±0.28200.34±4.98138.56±5.11Cry2A取食含有不同化合物的人工饲料的意大利蜜蜂幼虫的生命表参数表;含2.2表A.melliferaarametersofµg/gFW50纯人工饲料90.67±2.6785.33±3.895.79±0.1518.68±0.21199.02±3.35137.06±4.73。的饲料,浓度为PTable2.2Lifetable。Cry1C标准误,n=5)))±SE±SE)±SE<0.01,Dunnetttest))(mgP纯人工饲料为空白对照;含。表中数据表示为平均值±为显著差异)*1)2)3生命表参数化蛹率(%±SE羽化率(%±SE幼虫化蛹历期(days成虫羽化历期(days老熟幼虫体重新成虫体重(mg±SE中国农业科学院博士学位论文第二章Bt注:mg/gFW18
中国农业科学院博士学位论文第二章Bt蛋白对意大利蜜蜂幼虫的潜在影响2.4.2.3Bt蛋白生物活性在敏感昆虫生测试验中,分别用纯人工饲料、含Cry1C人工饲料和含Cry2A蜜蜂幼虫饲料提取物处理过的人工饲料喂养二化螟7天后,二化螟幼虫体重分别为1.71±0.12,0.92±0.11,0.19±0.11mg(图2.2)。Student’st-test分析结果显示,取食含Cry1C(t=4.91,df=57,P<0.001)或含Cry2A(t=11.91,df=54,P<0.001)人工饲料的二化螟体重与对照相比均显著减轻(图2.2)。图2.2取食了含有Cry1Ca和Cry2Aa蛋白处理过的人工饲料的7日龄二化螟体重Figure2.2WeightofC.suppressalislarvaethatfedfor7daysonanartificialdietthatcontainedanextractfrompureartificialdiet(control)orextractsfromartificialdietscontainingCry1CorCry2A注:1)图中数值为平均值+标准误,n=30。2)*为显著差异P<0.05,Dunnetttest。2.4.2.4蜜蜂幼虫肠道酶活性取食了含有BSA、Cry1C、Cry2A饲料的意蜂幼虫体内的总蛋白酶、类胰蛋白酶、氨肽酶和α-乙酸萘酯酯酶的活性与取食对照饲料蜜蜂相比均没有显著差异(Dunnett’stest;P>0.05;表2.3)。而取食了SBTI处理的人工饲料后,意蜂幼虫体内的总蛋白酶、类胰蛋白酶、氨肽酶和α-乙酸萘酯酯酶的活性与取食对照饲料蜜蜂相比均显著升高(Dunnett’stest;P<0.05)。19
中国农业科学院博士学位论文第二章Bt蛋白对意大利蜜蜂幼虫的潜在影响表2.3取食含有不同化合物的人工饲料的意大利蜜蜂幼虫的肠道内酶活性Table2.3EnzymeactivitylevelsingutsofA.melliferaligusticaworkerlarvaefedartificialdietcontainingdifferentcompounds酶活性处理t-ProTPSAMPα-NAE(U/L±SE)(U/mL±SE)(U/L±SE)(IU/mL±SE)纯人工饲料658.95±13.35522.95±27.3528.65±1.05157.85±3.80BSA757.40±54.65568.40±17.3530.90±1.15165.15±3.05Cry2A772.75±32.45579.25±25.2529.90±0.70165.20±6.65Cry1C701.40±85.15510.50±17.3029.60±1.00155.75±4.90SBTI1148.80±25.20*689.65±25.10*35.55±1.20*203.85±6.80*注:1)纯人工饲料为空白对照;含Cry1C的饲料,浓度为50µg/gFW;含Cry2A的饲料,浓度为400µg/gFW;含BSA的饲料作为阴性对照,浓度为400µg/gFW;混入SBTI的人工饲料为阳性对照,浓度为1mg/gFW。2)表中数据表示为平均值±标准误,n=7。3)*为显著差异P<0.01,Dunnetttest。20
中国农业科学院博士学位论文第二章Bt蛋白对意大利蜜蜂幼虫的潜在影响2.4.2.5Cry蛋白对蜜蜂幼虫组织病理学影响由图2.3中可以看出,意大利蜜蜂幼虫中肠是单层细胞结构。取食了纯人工饲料、BSA和分别含有Cry1C和Cry2A蛋白的饲料后,意大利蜜蜂幼虫的中肠肠壁细胞结构完整,细胞排列整齐,BBM清晰可见,各处理与空白对照相比没有明显差异(图2.3ABCD)。与之相反,在SBTI处理中,意大利蜜蜂幼虫肠壁细胞已经分解,并且从基膜脱离,同时BBM也严重溶解(图2.3E)。图2.3不同处理下意大利蜜蜂幼虫中肠切片照片Figure2.3LightmicrographsofmidgutsectionsofA.melliferaligusticalarvaethathadfedfor4daysondifferentartificialdietsA:纯人工饲料;B:BSA400µg/gFW;C:Cry1C50µg/gFW;D:Cry2A400µg/gFW;E:SBTIat1mg/gFW21
中国农业科学院博士学位论文第二章Bt蛋白对意大利蜜蜂幼虫的潜在影响2.5讨论评价转基因抗虫作物的非靶标效应,一般起始于可控条件下的实验室试验评价转基因抗虫作物表达的外源杀虫蛋白对受试生物的潜在毒性。为了最大可能地检测到杀虫蛋白对受试生物的潜在毒性,试验采取保守设计,一般要求,试验中受试生物被暴露于比其在田间环境中实际接触的杀虫蛋白10倍以上的浓度(worst-casesituation)(USEPA,2007)。为了达到这种目的,一般开展纯蛋白直接毒性试验,即所谓的Tier-1试验:发展合适的受试生物人工饲料,把高剂量的纯杀虫蛋白加入人工饲料直接饲喂受试生物(Duanetal.,2008;Lietal.,2008)。近年,人工饲养意大利蜜蜂幼虫的技术及饲料已经相对成熟,这使得通过人工饲料开展Tier-1试验评价纯杀虫蛋白对对意蜂幼虫的直接毒性成为可能。建立Tier-1试验体系,所采同的人工饲料能满足受试生物80%以上存活率。本研究中所采用人工饲料可满足意蜂幼虫的正常生长发育,幼虫存活率超过90%。为了进一步明确基于该蜜蜂幼虫人工饲料所构建的试验体系的有效性和敏感性,以已知对蜜蜂有毒的SBTI为模式化合物,研究了蜜蜂幼虫取食含不同剂量SBTI饲料的生物学反应。结果显示意蜂幼虫生命表参数与饲料中SBTI的浓度有明显的剂量-反应关系,如随着SBTI浓度的提高,蜜蜂幼虫存活率逐渐降低。这说明了所构建的试验体系可以用以检测杀虫化合物的毒性。而且,结果也显示:含SBTI浓度为1mg/g的人工饲料可以作为此类试验的阳性对照处理。利用所构建的试验体系,本研究评价了Cry1C(50µg/g)和Cry2A(400µg/g)两种Bt蛋白对意蜂幼虫的毒性影响。试验中两种Bt蛋白的浓度均高于其相对应Bt水稻花粉Bt蛋白浓度的10倍。目前已有研究表明水稻花粉中含有三种能吸引蜜蜂的挥发物,在水稻扬花期可以吸引蜜蜂访问水稻花,取食水稻花粉用于越夏和初秋繁殖(王丽华等,2005;刘家富,2013),因此在转基因水稻田中,蜜蜂可以通过取食转基因水稻花粉而接触杀虫蛋白。有研究证明意蜂整个幼虫阶段可取食1.5-2.0mg花粉(Babendreieretal.,2004),本研究中所使用的两种Cry蛋白的浓度远远高于在自然条件下意蜂幼虫接触到的Bt蛋白量。研究结果显示,取食含有Cry1C或Cry2A人工饲料后,意蜂幼虫生长发育并没有受到影响,而取食SBTI(1mg/g)处理的人工饲料,意蜂幼虫存活率显著降低,体重也明显下降。这些结果进一步明确了该试验体系可以检测杀虫化合物的毒性影响,意蜂幼虫可以通过人工饲料取食到Bt蛋白。为了进一步确认意蜂幼虫摄取到Cry蛋白的量,利用ELISA试验检测了分别饲喂2d和4d的幼虫体内Cry蛋白浓度。结果测得Cry1C处理中幼虫体内Cry1C蛋白含量分别为0.61±0.04µg/gFW和0.82±0.14µg/gFW;Cry2A处理中,Cry2A蛋白含量分别为29.11±2.01和18.70±1.02µg/gFW。这证明通过本试验方法,蜜蜂幼虫可取食到高浓度的Cry蛋白。但是在蛹中没有检测到任何Bt蛋白。这可能说明由于幼虫化蛹之前会将肠道内含物排出体外。这一现象与两种瓢虫(Stethoruspunctillum)和(Propyleajaponica)表现出的现象一致,瓢虫幼虫取食Bt蛋白后同样在蛹22
中国农业科学院博士学位论文第二章Bt蛋白对意大利蜜蜂幼虫的潜在影响中也没有检测到Cry蛋白(LiandRomeis,2010;Zhangetal.,2014;Lietal.,2015)。但是同样的情况在草蛉中并没有出现,当幼虫取食GNA或Cry蛋白后,在草蛉蛹和成虫体内仍能检测到相应杀虫蛋白(LiandRomeis,2009)。另外,本研究通过敏感昆虫生测试验验证了蜜蜂幼虫人工饲料中Cry蛋白的生物活性。分别取食了含Cry1C和Cry2A蜜蜂幼虫饲料提取物的人工饲料后,二化螟幼虫体重与对照相比均显著减轻。这一结果说明了意蜂幼虫通过人工饲料取食到了Cry1C和Cry2A蛋白保持其生物活性。中肠是消化吸收的主要场所,含有多种蛋白酶和解毒酶,同时也是杀虫蛋白的作用部位(王琛柱,1996a;刘贤进等,2003;张永军等,2005;张巍等,2008;李兆亮等,2011;张彦等,2012)。有研究表明,昆虫中肠蛋白酶的活性产生变化可能会直接影响原毒素的活化速度,因此中肠蛋白酶的活性与Bt蛋白对昆虫的毒性密不可分(蒋晴等,2013)。总蛋白酶、类胰蛋白酶、氨肽酶、α-乙酸萘酯酯酶活性通常被用在研究杀虫化合物对昆虫的毒性影响方面(王琛柱等,1996b;李伟等,1999;崔蕾等,2011;张彦等,2012)。本研究结果显示,取食了含有Cry2A或Cry1C蛋白的意蜂幼虫4种酶活性均没有明显变化,而SBTI处理中的意蜂幼虫各酶活性均明显上升。这说明取食两种Bt蛋白对意大利蜜蜂幼虫中肠内的主要酶活性没有影响。Bt毒素的作用机理为在昆虫摄入Bt毒素后,会作用在靶标害虫中肠内的结合点上,发生一系列反应后,导致害虫肠膜细胞渗透压发生改变,从而使肠膜遭到破坏,最终导致害虫死亡(陆琼,2008)。本研究通过组织病理学试验没有发现取食了两种Bt蛋白后的意蜂幼虫肠膜受到破坏,肠壁细胞发生裂解的现象。与之相反的是,在取食了含有SBTI的人工饲料后,意蜂幼虫的肠壁细胞分解,并且从基膜上脱离,同时BBM也严重溶解。本研究利用生物学、生理生化、组织病理学等手段系统地研究了两种Bt蛋白Cry1C和Cry2A蛋白对意大利蜜蜂幼虫的潜在毒性影响。结果说明了意大利蜜蜂幼虫对这两种Cry蛋白不敏感。这一结果与之前的对其它Cry蛋白(Cry1Ac,Cry1Ab,Cry2Ab,Cry3Bb1)的研究结果一致(Maloneetal.,2001;Roseetal.,2007;Hendriksmaetal.,2011b,2012)。23
中国农业科学院博士学位论文第三章两种Bt水稻花粉对意大利蜜蜂幼虫的潜在影响第三章两种Bt水稻花粉对意大利蜜蜂幼虫的潜在影响蜂巢中,1-3日龄幼虫以蜂王浆为食,随后,将发育成工蜂的幼虫会取食少量的花粉。有研究显示,一头意大利蜜蜂工蜂幼虫可取食1.52-2.04mg花粉,据计算,蜜蜂工蜂通过花粉取食到的蛋白质占其整个幼虫生长发育阶段所需蛋白质总量的5%左右(Babendreieretal.,2004)。转基因抗虫作物如Bt水稻的种植,蜜蜂幼虫可通过取食Bt植物花粉而暴露于Cry杀虫蛋白(vanderSteenetal.,2001)。因此,在抗虫转基因植物的环境风险研究中,评价取食转基因植物花粉对蜜蜂幼虫的潜在影响具有重要意义。在实验室条件下评价转基因抗虫作物的非靶标效应,主要开展三类试验:1)Tier-1试验,即将高剂量的、纯化的、有活性的杀虫蛋白以人工饲料为载体或用其它方式直接饲喂给受试生物,以检测Bt蛋白对受试生物的直接毒性(Romeisetal.,2004;Duanetal.,2008;Lietal.,2008);2)二级营养试验,对于可以直接取食植物组织如花粉的受试生物,可将转基因作物组织直接饲喂给受试生物的方式(Wangetal.,2012);3)三级营养试验,主要用于研究转基因抗虫作物对捕食性和寄生性天敌的潜在影响,用转基因植物组织和纯杀虫蛋白饲喂受试生物的猎物或寄主,然后把含转基因杀虫蛋白的猎物或寄主饲喂受试生物(LiandRomeis,2010;Lietal.,2013b)。意大利蜜蜂在水稻上的访花行为已经被许多研究证实(余玉生等,1999;刘家富,2013)。种植转基因抗虫水稻后,蜜蜂成虫将可能把转基因水稻花粉带回蜂巢饲喂给工蜂幼虫。本研究基于这一情况,分别将两种转Bt水稻花粉按一定比例加入人工饲料中饲喂给工蜂幼虫,研究这两种Bt水稻花粉对意大利蜜蜂工蜂幼虫的毒性影响。3.1材料和方法3.1.1供试昆虫意大利蜜蜂由中国农业科学院蜜蜂研究所提供。试验中所用幼虫取自三个蜂群。在继箱中(45x55x65cm)放入一张空脾,将蜂王放入该继箱中24小时,让其产卵。待卵孵化后第二天,用移虫针从巢脾中取出2日龄幼虫用于试验。3.1.2供试试剂Cry2A及Cry1CELISA试剂盒购于Envirotest-China(agentforEnvirologixInc.,Portland,Maine,USA;www.envirotestchina.com)。酶活测定试剂盒购于北京绿源博德生物技术有限公司。24
中国农业科学院博士学位论文第三章两种Bt水稻花粉对意大利蜜蜂幼虫的潜在影响3.1.3供试仪器人工气候箱(RXZ-380a),恒温培养振荡器(ZHWY-200D),GL-802A型微型台式真空泵,超纯水仪(UltraGenetic),离心机(Eppendorf,Centrifuge5415R,5418),酶标仪(PowerWaveXS2,BioTek),电子天平(Sartorius,CPA225D,d=0.01mg),涡旋仪(IKAMS3,Eppendorf),组织研磨器(G20,Coyotebio,r=1200rpm)。3.1.4供试花粉试验中所用Bt水稻品种为T2A-1和T1C-19分别表达Cry2A蛋白和Cry1C蛋白。两种转基因水稻及其亲本非转基因水稻明恢63(MH63)种子均由华中农业大学林拥军教授实验室提供。三个水稻品种同时种植在中国农科院植保所廊坊中试基地,栽培管理按当地常规管理方法实施,水稻生长期间不施用任何化学药剂。待水稻扬花期,每天采集花粉。采集后的花粉放置于阴凉通风处,晾干后用80目、200目筛子去除花药等杂质,处理干净的花粉分装到2mL离心管中,放入-20ºC冰箱保存直至使用。试验中所用的蜜蜂采集的杂花粉由中国农科院蜜蜂所代平礼老师实验室提供。使用前将花粉磨成粉末,放4ºC冰箱保存直至使用。3.2试验内容3.2.1意大利蜜蜂幼虫花粉――人工饲料的制备按照Babendreier等(2005)所报道的工蜂幼虫一生可消耗1.52-2.04mg花粉计算得出每100g人工饲料可加入375-500mg花粉。花粉中含有大量的蛋白质,因此,试验中用花粉代替部分酵母浸提粉来配制人工饲料,各成份配比如表3.1。表3.1花粉――人工饲料配方Table3.1Formulationofpollenartificialdiet成份比例(%)蜂王浆50去离子水37D(+)-果糖8D(+)-葡萄糖4酵母浸提粉0.5花粉0.525
中国农业科学院博士学位论文第三章两种Bt水稻花粉对意大利蜜蜂幼虫的潜在影响3.2.2生命表参数试验试验共包括4个处理:(1)杂花粉;(2)MH63花粉;(3)T2A-1花粉;(4)T1C-19花粉。人工饲料按表3.1配制,配制方法同2.2.1。配制好的人工饲料分装在5mL离心管中,放在-20ºC冰箱保存。使用前放在34ºC恒温箱中20min。并按照2.2.2所述方法进行实验。每个处理设6个重复,每个重复有12头意蜂幼虫。每天检查两次幼虫发育情况(9:00am;9:00pm),记录死亡个数,并称量老熟幼虫和新羽化成虫体重。3.2.3意蜂幼虫对Bt蛋白的摄取量测定分别将含有T2A-1、T1C-19、MH63花粉的人工饲料利用2.2.2所述方法饲喂意蜂幼虫,然后分别取5头饲喂了6天的幼虫和蛹用于ELISA检测。新鲜饲料中Cry蛋白含量同样使用ELISA试剂盒检测。取样后,将样品放在-20ºC冰箱中保存直至使用。ELISA检测之前,首先用PBST缓冲液将虫体表面残留的人工饲料清洗干净,然后再按照ELISA试剂盒说明书检测Cry蛋白含量。测定方法同2.2.4.2。3.2.4酶活测定试验同样,试验共包括4个处理:(1)杂花粉;(2)MH63花粉;(3)T2A-1花粉;(4)T1C-19花粉。人工饲料按表3.1配制,配制方法同2.2.1。并按照2.2.2所述方法进行饲喂意蜂幼虫。喂养4天后,将幼虫解剖,取出肠道后立即放入1.5mL离心管中,每管放一头幼虫肠道,每个处理取10头幼虫,即10个重复。取好的样品立即保存在-20ºC冰箱中。解剖方法和酶活测定方法同2.2.4.4。3.3统计分析老熟幼虫体重、新羽化成虫体重、化蛹率、羽化率均用Dunnett"stest检测。幼虫发育到蛹和成虫的时间用KruskalWallistest检验。所有数据均利用SPSS(version13,2004)进行分析。3.4结果分析3.4.1生命表参数从表3.2中可以看出,所有处理中幼虫化蛹率均在90%以上,羽化率也大于80%。与MH63花粉处理相比,分别取食了含有杂花粉、T2A-1花粉、T1C-19花粉的饲料后,意蜂幼虫化蛹率、羽化率、发育到老熟幼虫的时间,羽化历期均没有显著差异(Dunnett’stest;P>0.05)(表3.2)。T2A-1花粉、T1C-19花粉处理的老熟幼虫体重和新羽化成虫体重虽然均高于MH63花粉处理中的幼虫,但是均没有达到显著水平(Dunnett’stest;P>0.05)(表3.2)。26
中国农业科学院博士学位论文第三章两种Bt水稻花粉对意大利蜜蜂幼虫的潜在影响表3.2取食Bt水稻花粉对意大利蜜蜂幼虫生长发育的影响Table3.2EffectofconsumptionofBtricepollenonthedevelopmentofA.melliferaligusticaworkerlarvae生命表参数杂花粉MH63花粉Cry2A花粉Cry1C花粉化蛹率(%±SE)90.28±3.9894.44±2.7893.06±2.5695.83±1.86羽化率(%±SE)81.94±2.5681.39±3.9886.11±5.1281.94±5.86幼虫发育历期(days±SE)6.04±0.096.09±0.036.14±0.056.12±0.05羽化历期(days±SE)18.39±0.1918.39±0.1918.40±0.1918.34±0.21老熟幼虫体重(mg±SE)210.60±2.26211.46±2.16213.00±2.47216.66±3.38新成虫体重(mg±SE)114.38±2.01117.07±1.52114.59±1.65116.72±1.88注:1)杂花粉、Cry1C花粉和Cry2A花粉处理均与MH63花粉处理比较。2)表中数据表示为平均值±标准误,n=6。3.4.2蜜蜂幼虫对Bt蛋白的摄取量ELISA结果显示:两种新鲜饲料中Cry1C和Cry2A含量分别为0.90±0.26ng/gFW和7.37±0.62ng/gFW。分别取食了含Cry1C花粉和Cry2A花粉人工饲料蛹体内均没有检测到相应的Bt蛋白。在Cry1C花粉处理中,6日龄幼虫体内Cry1C蛋白含量为2.37±0.50ng/gFW。Cry2A花粉处理中,6日龄幼虫体内Cry2A蛋白含量为18.84±1.30ng/gFW。3.4.3意大利蜜蜂幼虫肠道酶活性测定取食杂花粉和MH63花粉处理的人工饲料后,意大利蜜蜂幼虫肠道内总蛋白酶、类胰蛋白酶、氨肽酶和α-乙酸萘酯酯酶活性差异均不显著(Dunnett’stest;P>0.05)(表3.3)。取食了分别含有T2A-1花粉、T1C-19花粉的人工饲料的意蜂幼虫体内总蛋白酶、类胰蛋白酶、氨肽酶和α-乙酸萘酯酯酶的活性与MH63处理相比也没有明显差异(Dunnett’stest;P>0.05)(表3.3)。27
中国农业科学院博士学位论文第三章两种Bt水稻花粉对意大利蜜蜂幼虫的潜在影响表3.3取食不同水稻品种花粉对意大利蜜蜂幼虫肠道酶活性的影响Table3.3EffectonenzymeactivitylevelsingutsofA.melliferaligusticaworkerlarvaewhyenfedpollenfromdifferentricelines酶活性处理t-ProTPSAMPα-NAE(U/L±SE)(U/mL±SE)(U/L±SE)(IU/mL±SE)杂花粉408.00±5.05412.64±10.6918.07±0.52113.17±2.59MH63花粉418.48±6.06418.95±20.5618.90±0.81112.12±1.80T2A-1花粉403.21±8.48416.71±17.0118.76±0.86110.56±1.18T1C-19花粉422.98±8.51423.84±22.1719.34±0.51113.41±3.60注:1)常规花粉、Cry1C花粉和Cry2A花粉处理均与MH63花粉处理比较。2)表中数据表示为平均值±标准误,n=6。3.5讨论Babendreier等人的研究证实了意大利蜜蜂幼虫可以取食到花粉,并且可以通过花粉直接取食大量蛋白质(Babendreieretal.,2004)。在转基因作物的大面积种植条件下,意蜂幼虫可能因取食转基因作物花粉而暴露于转基因杀虫蛋白。因此,评估取食抗虫转基因植物花粉对蜜蜂幼虫的潜在影响是十分必要的。由于以前缺少在蜂巢外饲养蜜蜂幼虫的方法,因此,在研究转基因作物对意大利蜜蜂的潜在毒性时,大部分研究都集中在对蜜蜂成蜂毒性影响方面。在评估转基因抗虫作物对意大利蜜蜂幼虫潜在影响的研究中,一般将花粉直接置于蜂巢中,如田岩等将转cry1Ab玉米和转cry1Ac棉花花粉直接放入蜂巢中,让哺育蜂把花粉饲喂给意蜂幼虫,来研究取食两种Bt作物花粉对意大利蜜蜂幼虫的毒性(田岩等,2006a,b)。近些年,随着意大利蜜蜂幼虫人工饲料的出现和人工饲养方法的完善,使在蜂巢外研究转基因杀虫蛋白或转基因作物花粉对意大利蜜蜂幼虫的毒性影响成为可能。Hendriksma等利用半人工饲料和体外饲养的方法研究了两种转基因玉米DKc7565和Mon89034xMon88017花粉对意大利蜜蜂幼虫的潜在影响,结果显示,与非转基因玉米花粉相比,没有发现两种转基因玉米花粉对意蜂幼虫的存活率和预蛹体重有任何影响(Hendriksmaetal.,2011b)。水稻花粉并不是意大利蜜蜂的主要食物来源,但有许多研究证实在水稻扬花期意大利蜜蜂可以采集并携带水稻花粉返回500米处的蜂巢内(刘家富,2013)。转基因水稻种植后,表达杀虫蛋白的水稻花粉可随着采集蜂进入蜂巢,并由哺育蜂饲喂给意蜂工蜂幼虫。本研究利用现有的意大利蜜蜂工蜂幼虫人工饲喂方法评价了两种转基因抗虫水稻品系T2A-1和T1C-19对意大利蜜蜂工蜂幼虫的潜在毒性。结果显示,取食了加入花粉的人工饲料,意蜂幼虫化蛹率达90%以上,羽化率也大于80%。这说明,在人工饲料中0.5%的花粉替代0.5%酵母后,28
中国农业科学院博士学位论文第三章两种Bt水稻花粉对意大利蜜蜂幼虫的潜在影响仍能为幼虫的完全发育提供充足的营养。转基因水稻T2A-1花粉、T1C-19花粉处理的意蜂幼虫与非转基因水稻MH63花粉处理相比,其生长发育并没有受到影响。同时,酶活性测定结果也显示,取食了T2A-1花粉的幼虫后,肠道内主要蛋白酶及解毒酶活性均低于非转基因水稻处理,但是差异并不显著;而T1C-19花粉处理的幼虫体内总蛋白酶、类胰蛋白酶、氨肽酶及α-乙酸萘酯酯酶活性均有所升高,但是也没有达到显著水平。ELISA结果证明了试验中蜜蜂幼虫确实取食到了转基因水稻T2A-1花粉、T1C-19花粉。蛹体内没有检测出任何Bt蛋白,但是6日龄幼虫体内检测出了相应的Cry蛋白,并且浓度为新鲜饲料中浓度的2-3倍,可能说明Cry蛋白在幼虫体内有所积累。结果说明,通过所建立的饲喂方法,意大利蜜蜂幼虫可以取食一定量的Bt花粉,该方法可用于研究转基因抗虫作物花粉对蜜蜂幼虫的潜在影响。总之,本研究表明取食两种转基因抗虫水稻T2A-1和T1C-19花粉对意大利蜜蜂工蜂幼虫的生长发育没有影响。29
中国农业科学院博士学位论文第四章Bt蛋白及Bt花粉对意大利蜜蜂成虫的毒性影响第四章Bt蛋白及Bt花粉对意大利蜜蜂成虫的毒性影响水稻(OryzasativaL.)起源于中国、印度及印度尼西亚,是我国乃至世界最重要的粮食作物之一。水稻种植主要集中在亚洲地区,种植面积占世界的90%以上,而我国是最大的水稻生产国(刘平,2014)。但是大螟(Sesamiainferens)、二化螟、稻纵卷叶螟等螟虫及褐飞虱(Nilaparvatalugens)、白背飞虱(Sogatellafurcifera)等稻飞虱的发生严重影响了水稻产量,每年由这些害虫造成的经济损失达数亿美元(Chenetal.,2011)。化学农药的大量使用不仅破坏了农田生态系统的多样性和稳定性,而且带来了农药残留问题。因此,传统害虫防治方法已经不能满足水稻生产的需要。自1993年Fujimoto等人首次报道成功获得Bt水稻后,各国已先后研制出多种抗鳞翅目害虫的转基因水稻品种(Bashiretal.,2005;Chenetal.,2008;Cohenetal.,2008)。用于转基因抗虫水稻的基因主要有cry1Ab,cry1Ac,cry1Aa,cry1Ab/Ac,cry2Aa,cry1C等Bt基因和豇豆胰蛋白酶抑制剂CpTI基因(Zhangetal.,2011)。转基因作物进入商业化应用前必须通过严格的安全性评价,其中评价其对非靶标生物的潜在影响是一个重要方面(王丽华等,2005;韩兰芝等,2006;卢宝荣等,2008;胡跃东,2010)。蜜蜂主要以花粉和花蜜为食,并可以为多种农作物传粉授粉。研究显示水稻扬花期可以产生大量的花粉,并可吸引蜜蜂采集花粉(赖友胜等,1985;王丽华等,2005;胡跃东,2010)。这样,转基因抗虫水稻大面积种植后,蜜蜂可能会因取食转基因水稻花粉而暴露于其表达的外源杀虫蛋白。因此,在商业化种植前评价取食转基因抗虫水稻花粉对蜜蜂成虫的潜在影响是十分重要的。4.1材料方法4.1.1供试昆虫意大利蜜蜂蜂群由中国农业科学院蜜蜂研究所提供。试验前将空脾放入继箱中,蜂王在空脾上产卵24h。待封盖9d后,将封盖子脾放入培养箱中,条件为40±1ºC,RH70±10%,无需光照。将新出房的幼蜂(<24h)放入蜂笼(9×9×10cm)中进行试验。4.1.2供试花粉试验中所用Bt水稻品种为T2A-1和T1C-19分别表达Cry2A蛋白和Cry1C蛋白。两种转基因水稻及其亲本非转基因水稻明恢63种子均由华中农业大学林拥军教授实验室提供。三个水稻品种同时种植在中国农科院植保所廊坊中试基地,栽培管理按当地常规管理方法实施,水稻生长期间不施用任何化学药剂。待水稻扬花期,每天采集花粉。采集后的花粉放置于阴凉通风处,晾干后用80目、200目筛子去除花药等杂质,处理干净的花粉分装到2mL离心管中,放入-20ºC冰箱保存直至使用。试验中所用的杂花粉由中国农科院蜜蜂所代平礼老师实验室提供。使用前将花粉磨成粉末,30
中国农业科学院博士学位论文第四章Bt蛋白及Bt花粉对意大利蜜蜂成虫的毒性影响放4ºC冰箱保存直至使用。4.1.3供试试剂Cry1C和Cry2A纯蛋白及相应的ELISA试剂盒均购于Envirotest-China(AgentforEnvirologixInc.,Portland,Maine,USA;www.envirotestchina.com)。Cry1C和Cry2A纯蛋白纯度为94-96%。这两种Cry蛋白的生物活性通过敏感昆虫生测试验测定,Cry1C蛋白的EC50为18.1ng/mL,Cry2A蛋白EC50为1310.3ng/mL。酶活测定试剂盒购于北京绿源博德生物技术有限公司(北京,中国)。蜂蜜购于北京中农蜂蜂业技术发展公司(北京,中国)。无机化合物砷酸二氢钾(potassiumarsenate,PA,KH2AsO4)购于Sigma-Aldrich(St.Louis,MO)。4.2Bt纯蛋白试验以蔗糖水为载体将杀虫蛋白传递给意大利蜜蜂成虫。蔗糖水浓度为50%,即蔗糖与去离子水质量比为1:1。在加入受试蛋白时,先将受试蛋白按所需浓度加入去离子水中完全溶解,再加入蔗糖搅拌均匀。蜜蜂采集的杂花粉粉末用于试验,以提供营养。试验时,分别将糖水和花粉粉末用自制容器盛放后放置在蜂笼中饲喂意蜂成虫。容器均用5mL离心管制成。用昆虫针在5mL离心管壁上穿6-8个小孔,可供蜜蜂取食糖水,并避免水份蒸发;用电铬铁将5mL离心管一面去除1/2,以便盛放花粉。4.2.1工蜂存活率测定意蜂成虫的存活率测定试验共设6个处理:(1)50%蔗糖水,作为空白对照;(2)含BSA的糖水,浓度为400µg/g,作为阴性对照;(3)含Cry2A的糖水,浓度为400µg/g;(4)含Cry1C糖水,浓度为50µg/g;(5)SBTI浓度为1mg/g的糖水;(6)浓度为10mg/gSBTI的糖水,作为阳性对照;(7)只有清水的处理。试验时,随机抓取新出房的工蜂放入自制养蜂笼中,每笼30头成蜂。蔗糖水和杂花粉粉末分别盛放在自制容器中饲喂给蜜蜂。每笼每天提供2mL糖水,和足够量的花粉。每一笼为一个重复,每个处理各5笼,即5个重复。除上述处理,另设一个清水处理,所有处理中的蜜蜂只提供给清水,共3个重复。每天记录蜜蜂死亡个数,并将死亡的蜜蜂清理出笼子。试验共持续35天。4.2.2王浆腺腺泡直径测定试验意大利蜜蜂工蜂在羽化后第6-12天为哺育蜂,在第10天时其王浆腺腺泡直径达到最大。为测定意蜂王浆腺腺泡直径,按照上述方法将蜜蜂工蜂饲喂到第10天。试验共5个处理:(1)50%31
中国农业科学院博士学位论文第四章Bt蛋白及Bt花粉对意大利蜜蜂成虫的毒性影响蔗糖水;(2)含BSA的糖水,浓度为400µg/g;(3)含Cry2A糖水,浓度为400µg/g;(4)含Cry1C的糖水,浓度为50µg/g;(5)含SBTI的糖水,浓度为1mg/g。每个处理取20头蜂进行测量,每一头蜂随机测量10个王浆腺腺泡。测量方法如下:将工蜂头部用解剖剪剪下,置于体视显微镜下,用一把尖头镊子固定住头部,另一把镊子将复眼挑开,然后将王浆腺取出,放在一滴0.9%生理盐水中进行观察。利用显微镜成像系统进行照相,最后用明美显微数码测量分析系统对王浆腺腺泡直径进行测量。4.2.3意蜂中肠酶活性测定试验为测定意蜂中肠主要酶的活性,按照上述饲喂方式将蜜蜂成虫饲喂10天,进行酶活测定试验。试验共设5个处理:(1)50%蔗糖水;(2)含BSA的蔗糖水(浓度为400µg/g);(3)含Cry2A的蔗糖水(浓度为400µg/g);(4)含Cry1C的蔗糖水(浓度为50µg/g);(5)含SBTI的蔗糖水(浓度为1mg/g)。10天后取样,每个处理各取6头蜜蜂,将中肠取出进行试验,方法如下:在冰浴上用镊子镊住工蜂尾针后将整个肠道拉出,然后将中肠和后肠分离后分别放入1.5mL离心管中。每个处理取6头工蜂进行解剖,取出的中肠放置在-20ºC冰箱保存。测定酶活时,将中肠置于400µL预冷的0.9%的NaCl溶液,在1.5mL的离心管中用自动研磨器进行研磨。然后在4ºC离心机中以3000rpm离心10分钟,取上清液进行试验。试验共测定4种酶的活性:总蛋白酶,类胰蛋白酶,氨肽酶和α-乙酸萘酯酯酶。测定方法同2.2.4.4。4.2.4Bt蛋白摄取量分析为明确意蜂对Bt蛋白的摄取量,用上述饲喂方式将Cry蛋白饲喂蜜蜂成虫并进行ELISA试验。试验设3个饲料处理:(1)50%蔗糖水;(2)含Cry2A的糖水浓度为400µg/g;(3)含Cry1C的糖水,浓度为50µg/g。分别在饲喂5天,10天和15天时采集各处理中的10头工蜂,保存在-20ºC冰箱中至ELISA测定试验。测定方法同2.2.4.2。4.3Bt花粉试验为研究Bt水稻花粉对意蜂成虫的潜在影响,将水稻花粉、蜂蜜和水按照5:4:1的比例混合均匀饲喂给意蜂成虫,并用加入了有毒化合物PA的杂花粉作为阳性对照。4.3.1存活率测定试验存活率测定试验中共5个处理:(1)MH63花粉;(2)转cry1C花粉(T1C-19);(3)转cry2A花粉(T2A-1);(4)混入PA的杂花粉,浓度为10µg/g和(5)混入PA的杂花粉50µg/g。试验时随机抓取新出房工蜂放入蜂笼中,并将盛有花粉的自制容器放入蜂笼中饲喂工蜂,同时用另一容器提供清水。每笼30头工蜂,每个处理4笼,即4个重复。每天检查蜜蜂死亡个数,并将死亡的蜜蜂清理出蜂笼。每天更换花粉饲料。饲喂10天后结束实验。32
中国农业科学院博士学位论文第四章Bt蛋白及Bt花粉对意大利蜜蜂成虫的毒性影响4.3.2王浆腺腺泡直径测定试验本试验中共设4个处理:(1)MH63花粉;(2)转cry1C花粉(T1C-19);(3)转cry2A花粉(T2A-1);(4)混入PA的杂花粉,浓度为10µg/g。并按照上述方法将蜜蜂工蜂饲喂到第10天后,测定工蜂王浆腺腺泡直径。每个处理取10头工蜂。取样及测定方法同4.2.2。4.3.3意蜂中肠酶活性测定试验本试验中共设4个处理:(1)MH63花粉;(2)转cry1C花粉(T1C-19);(3)转cry2A花粉(T2A-1);(4)混入PA的杂花粉,浓度为10µg/g。并按照上述方法将蜜蜂工蜂饲喂到第10天后将蜜蜂中肠取出用于试验。每个处理取6头工蜂用于测定试验。取样及酶活测定方法同4.2.3。4.3.4Bt蛋白摄取量测定为确定工蜂对Bt蛋白的摄入量,分别取用Bt花粉饲喂意蜂工蜂后进行ELISA测定试验。试验共3个处理:(1)MH63花粉;(2)转cry1C花粉(T1C-19);(3)转cry2A花粉(T2A-1)。并按上述方法进行饲喂工蜂。每个处理分别取饲喂了5天,10天的工蜂各6头用于测定试验。另外,新鲜花粉饲料及暴露两天的花粉饲料中Bt蛋白含量也用ELISA试验测定。ELISA测定方法同2.2.4.2。4.4数据分析Bt蛋白处理中工蜂存活率、王浆腺腺泡直径、酶活性、花粉饲料中Bt蛋白含量均用Dunnetttest检验;Bt花粉处理中工蜂存活率、王浆腺腺泡直径、t-Pro、AMP活性用Dunnetttest检验;TPS活性用Mann-WhitneyU检验;α-NAE活性用KruskalWallistest检验。所有数据均利用SPSS(version13,2004)进行分析。4.5结果与分析4.5.1Bt纯蛋白试验结果4.5.1.1工蜂存活率测定只喂清水的处理中,试验所用意大利蜜蜂工蜂在3天内全部死亡。从图4.1中可以看出,在试验的35天中,随着饲喂天数的增加,所有处理中意大利蜜蜂工蜂存活率均呈下降趋势,浓度为10mg/g的SBTI处理下降速度最快,在第22天时,该处理的蜜蜂全部死亡,其它各处理在试验结束时,仍有蜜蜂存活。试验结束后,分别对各处理在第7天,14天,21天,28天,35天的工蜂存活率进行了统计33
中国农业科学院博士学位论文第四章Bt蛋白及Bt花粉对意大利蜜蜂成虫的毒性影响分析(表4.1)。在第7天时,所有处理与空白对照相比,存活率均没有显著性差异(P>0.05)。从第14天开始存活率出现差异,其中高浓度SBTI处理与空白对照相比,存活率较小,并有显著性差异(P<0.01)。BSA、Cry1C处理与空白对照之间工蜂存活率在各个阶段都没有明显差异(P>0.05)。虽然Cry2A处理在第14天时,存活率明显小于空白对照处理,但是随后的3个阶段存活率均高于空白对照,但是差异不显著(P>0.05)。浓度为1mg/g的SBTI处理中,每个阶段的存活率均小于空白对照,但是都没有达到差异显著水平(P>0.05)。表4.1取食不同蛋白处理的意大利蜜蜂存活率(%±SE)Table4.1SurvivalrateofA.melliferaligusticaadultsfeedingonsucrosesolutioncontainingdifferentproteins饲喂天数处理7d14d21d28d35d纯糖水96.80±0.8083.20±2.3340.80±6.1226.40±5.1515.20±6.25BSA400μg/g90.40±4.4980.00±5.0645.60±9.4336.80±12.5528.80±12.8Cry2A400μg/g94.34±2.6270.37±0.68*55.50±4.0343.26±4.2335.95±4.13Cry1C50μg/g97.63±0.9777.82±9.7952.78±10.2026.45±6.9815.14±8.77SBTI1mg/g96.18±1.7376.21±3.2434.70±7.1421.75±6.548.50±5.28SBTI10mg/g83.32±8.1918.93±8.16*1.48*0*-34
中国农业科学院博士学位论文第四章Bt蛋白及Bt花粉对意大利蜜蜂成虫的毒性影响图4.1取食不同糖水处理的意大利蜜蜂成虫存活率曲线Fig.4.1SurvivalcurveofA.melliferaligusticaadultsfeedingonsurcousesolutionscontainingdifferentcompounds4.5.1.2王浆腺腺泡直径测定从图4.2中可以看出,BSA、Cry2A蛋白、Cry1C蛋白处理与空白对照中,意大利蜜蜂工蜂王浆腺腺泡平均直径均在100µm以上,并且三个蛋白处理与空白对照之间没有显著性差异(P>0.05)。SBTI处理的意大利蜜蜂王浆腺腺泡平均直径为84.40±2.07µm,明显小于空白对照中意蜂王浆腺腺泡平均直径(P<0.01)。35
中国农业科学院博士学位论文第四章Bt蛋白及Bt花粉对意大利蜜蜂成虫的毒性影响图4.2取食不同糖水处理的意大利蜜蜂成虫王浆腺腺泡直径Fig.4.2AcindismeterofhypopharyngealglandofA.melliferaligusticaadultsfeedingonsurcousesolutionscontainingdifferentcompoundsControl:50%糖水;BSA:含BSA的糖水(400µg/g);Cry2A:含Cry2A的糖水(400µg/g);Cry1C:含Cry1C的糖水(50µg/g);SBTI:含SBTI的糖水(1mg/g)4.5.1.3中肠酶活性测定表4.2中给出了各试验处理中意大利蜜蜂工蜂中肠主要蛋白酶和解毒酶的活性数值。分析结果显示分别取食了含有BSA、Cry1C、Cry2A蛋白的蔗糖水后,意大利蜜蜂工蜂中肠内的总蛋白酶、类胰蛋白酶、氨肽酶和α-乙酸萘酯酯酶的活性与纯糖水(空白对照)相比均没有显著性差异(Dunnett’stest;P>0.05)(表4.2)。SBTI处理中,意大利蜜蜂中肠类胰蛋白酶、氨肽酶活性与纯糖水处理相比没有显著性差异(Dunnett’stest;P>0.05),但是总蛋白酶、α-乙酸萘酯酯酶活性均明显高于纯糖水处理(P<0.01)。36
中国农业科学院博士学位论文第四章Bt蛋白及Bt花粉对意大利蜜蜂成虫的毒性影响表4.2取食不同蛋白处理的意大利蜜蜂中肠酶活性Table4.2EnzymeactivitylevelsinA.melliferaligusticaadultsfeedingonsucrosesolutioncontainingdifferentproteins酶活性处理t-ProTPSAMPα-NAE(U/L±SE)(U/mL±SE)(U/L±SE)(IU/mL±SE)纯糖水440.17±21.15531.70±21.2821.69±0.65127.32±6.42BSA400μg/g424.01±16.48453.79±45.8918.11±1.73108.75±13.29Cry2A400μg/g431.80±16.62463.89±29.2519.09±1.29108.30±7.80Cry1C50μg/g420.51±17.74464.28±29.8519.29±1.53116.74±10.61SBTI1mg/g632.67±27.80*567.70±25.1125.92±0.83181.53±8.64*4.5.1.4Bt蛋白摄取量测定在两个Bt蛋白处理中,通过ELISA试验从5d,10d,15d意大利蜜蜂体内均检测出了相应的Cry蛋白,对照处理中的意大利蜜蜂体内没有检测到任何Cry蛋白。Cry2A和Cry1C蛋白含量在意大利蜜蜂体内呈现相同的趋势:在第5和15天Cry蛋白含量相对较高,均高于第10天的含量,第15天Cry蛋白含量最高(表4.3)。表4.3取食含有Bt蛋白的饲料的意大利蜜蜂体内Cry蛋白的含量Table4.3ConcentrationsofCryproteinsinA.melliferaligusticaadultsfeedingonsucrosesolutioncontainingBtproteinsCry蛋白含量(μg/gDW)处理5d10d15dCry2A蛋白80.58±12.4058.53±13.5789.57±19.72Cry1C蛋白6.18±1.384.11±0.9218.60±3.4037
中国农业科学院博士学位论文第四章Bt蛋白及Bt花粉对意大利蜜蜂成虫的毒性影响4.5.2Bt花粉试验4.5.2.1存活率测定图4.3显示,随着饲喂天数的增加,所有处理中意大利蜜蜂工蜂存活率均呈下降趋势,浓度为50µg/g的PA处理下降速度最快,在第5天时,该处理的蜜蜂全部死亡,其它各处理在试验结束时,仍有蜜蜂存活。分别选取各处理在第2天,4天,6天,8天,10天的工蜂存活率进行了统计分析(表4.4)。Cry2A花粉和Cry1C花粉处理与MH63花粉相比,所有阶段的存活率均没有显著性差异(P>0.05)。低浓度PA处理中,在第10天时,意大利蜜蜂存活率明显比MH63花粉处理减小(P<0.01)。高浓度PA处理每个阶段的存活率均小于MH63处理的存活率,并从第4天开始,存活率出现明显差异(P<0.01)。表4.4取食不同花粉处理的意大利蜜蜂存活率Table4.4SurvivalrateofA.melliferaligusticaadultsfeedingondifferentpollen饲喂天数处理2d4d6d8d10dMH63花粉10098.00±1.3394.67±3.2788.67±3.0969.33±6.09Cry2A花粉10010087.33±11.0379.33±10.4649.33±11.47Cry1C花粉99.33±0.6798.67±0.8296.00±1.6388.67±4.9062.67±7.77PA10μg/g10096.02±2.4592.71±2.6763.42±11.8711.94±5.84*PA50μg/g93.33±5.095.56±4.01*0*--注:1)试验中各处理均与MH63花粉相比较,n=5。2)*为显著差异P<0.05α=0.01,n=5,Mann-WhitneyUtest。38
中国农业科学院博士学位论文第四章Bt蛋白及Bt花粉对意大利蜜蜂成虫的毒性影响图4.3取食不同花粉的意大利蜜蜂成虫存活率曲线Fig.4.3SurvivalcurveofA.melliferaligusticaadultsfeedingondifferentpollenMH63:MH63水稻花粉;T2A-1:转cry2A水稻花粉;T1C-19:转cry1C水稻花粉;PA10µg/g:含PA的杂花粉(10µg/g);PA50µg/g:含PA的杂花粉(50µg/g)4.5.2.2王浆腺腺泡直径测定从图4.4中看出,MH63、Cry2A和Cry1C花粉处理中的意大利蜜蜂王浆腺腺泡平均直径均大于100µm,并且任一Bt花粉处理与非Bt处理之间没有显著性差异(P>0.05)。取食了PA处理的花粉后,意大利蜜蜂王浆腺腺泡平均直径为81.72±2.01µm,明显小于MH63花粉处理中的意蜂王浆腺腺泡直径(P<0.01)。39
中国农业科学院博士学位论文第四章Bt蛋白及Bt花粉对意大利蜜蜂成虫的毒性影响图4.4取食不同花粉的意大利蜜蜂成虫王浆腺腺泡直径Fig.4.4AcindismeterofhypopharyngealglandofA.melliferaligusticaadultsfeedingondifferentpollenMH63花粉:MH63水稻花粉;T2A-1花粉:转cry2A水稻花粉;T1C-19花粉:转cry1C水稻花粉;PA10µg/g:含PA的杂花粉(10µg/g)4.5.2.3中肠酶活性测定表4.5显示,取食了Cry1C花粉后,意大利蜜蜂中肠内总蛋白酶、类胰蛋白酶、氨肽酶和α-乙酸萘酯酯酶的活性与MH63花粉处理中没有明显差异(P>0.05)。Cry2A花粉处理与MH63花粉相比,意大利蜜蜂中肠内总蛋白酶、氨肽酶和a-乙酸萘酯酯酶的活性没有显著地变化,但是类胰蛋白酶活性明显高于非转基因花粉处理(P<0.01)。表4.5取食不同花粉处理的意大利蜜蜂中肠酶活性Table4.5EnzymeactivitylevelsinA.melliferaligusticaadultsfeedingondifferentpollen酶活性处理t-ProTPSAMPα-NAE(U/L±SE)(U/mL±SE)(U/L±SE)(IU/mL±SE)MH63花粉462.91±16.18413.57±19.2018.82±1.62117.66±8.24T2A-1花粉489.62±13.94463.86±13.31*20.32±0.85130.98±5.65T1C-19花粉423.57±10.63392.04±15.0417.60±1.06114.92±8.32注:1)Cry2A花粉、Cry1C花粉处理均与MH63花粉相比较,n=6。2)*为显著差异P<0.05。40
中国农业科学院博士学位论文第四章Bt蛋白及Bt花粉对意大利蜜蜂成虫的毒性影响4.5.2.4Bt蛋白摄取量测定ELISA结果显示,分别取食了Cry2A花粉和Cry1C花粉后,所有意大利蜜蜂样品中均检测出相应的Cry蛋白,同时MH63处理的样品中,没有检测出任何Cry蛋白。两个Bt花粉处理中,新鲜饲料和暴露了2天的饲料中也检测出了相应的Cry蛋白,且暴露2天的花粉饲料中Cry蛋白含量均低于新鲜饲料,但是达不到显著水平(P>0.05)。Cry2A花粉处理中,第10天的意大利蜜蜂体内Cry2A蛋白含量高于第5天;而Cry1C花粉处理中,第10天的Cry1C蛋白含量低于第5天(表4.6)。新鲜花粉及暴露2天的花粉饲料中均检测出Cry蛋白,并且两个Bt花粉处理中暴露了2天的花粉饲料中Cry蛋白含量与新鲜花粉相比均有下降,但是达不到显著水平(P>0.05,Dunnetttest)(表4.6)。表4.6取食不同花粉处理的意大利蜜蜂体内Cry蛋白含量Table4.6ConcentrationsofCryproteinsinA.melliferaligusticaadultsfeedingondifferentpollenCry蛋白含量(µg/gDW)处理新鲜饲料2d饲料5d工蜂10d工蜂T2A-1花粉29.14±2.6526.22±1.201.45±0.402.17±0.40T1C-19花粉1.62±0.041.16±0.080.33±0.050.21±0.0241
中国农业科学院博士学位论文第四章Bt蛋白及Bt花粉对意大利蜜蜂成虫的毒性影响4.6讨论蜜蜂作为一种重要的经济和社会性昆虫,其在转基因作物风险评估中的地位也举足轻重(Hectoretal.,2008)。转基因作物风险评估工作者经常将其列为转基因非靶标影响研究中的试验对象(Maloneetal.,2011)。在研究转基因抗虫作物的非靶标影响时,一般采用分层次评价体系进行,主要包括实验室试验、半田间试验和田间试验三个阶段(Romeisetal.,2008b;王园园等,2011)。实验室试验阶段主要是在一个可控的环境中,将杀虫蛋白以高于受试生物田间可能接触到的实际浓度10倍以上的浓度,以人工饲料等方式直接饲喂给受试生物,或者将表达有杀虫蛋白的转基因植物组织让受试生物取食,以此来检验杀虫蛋白对受试生物是否有毒性(Romeisetal.,2004;Romeisetal.,2006;Lietal.,2013c,2014)。如前所述,如果转基因抗虫水稻大面积种植,那么意大利蜜蜂在水稻的上的访花行为及采集行为使得蜂群有机会直接接触到转基因产物,如杀虫蛋白及转基因片段等(MaloneandPham-Deleguep,2001;刘艳荷等,2001;李健等,2003;王丽华等,2005;张兰等,2005;MaloneandBurgess,2009)。本研究正是采用了上述两种方法,在实验室水平上开展了两种转基因抗虫水稻T2A-1和T1C-19对意大利蜜蜂的毒性影响的研究。在Bt蛋白试验中,利用50%的蔗糖溶液为载体,将两种Cry蛋白以相当高地浓度提供给意大利蜜蜂。其中Cry2A蛋白浓度为400µg/g,Cry1C浓度为50µg/g,而这两种蛋白在转基因水稻花粉中的表达量分别为33.5±4.3µg/g和2.25±0.33µg/g(Wangetal.,2012;Lietal.,2015),因此,本研究中所设计的Cry蛋白浓度均大于意大利蜜蜂田间可接触到的最高浓度的10倍。试验结果显示,在持续取食了5周高浓度的Cry2A和Cry1C蛋白后,意大利蜜蜂的存活率并没有受到显著影响。这与对其它Cry蛋白(Cry1Ba,Cry1Ab,Cry1Ah)的研究结果相一致(Maloneetal.,1999;Maloneetal.,2001,2004;Babendreieretal.,2005;Daietal.,2012a,b)。大豆胰蛋白酶抑制剂SBTI是一种非常重要的杀虫蛋白,具有较高的杀虫效果,但是其对有益昆虫等也有危害。早有研究指出在蔗糖溶液中加入1%的SBTI后饲喂给蜜蜂,会导致蜜蜂死亡(Maloneetal.,1995)。本研究根据该结果设定了两个不同浓度的SBTI作为阳性对照,分别为0.1%和1%。结果显示,取食了低浓度的SBTI后,意大利蜜蜂在各个阶段的存活率均小于纯糖水对照处理,但是没有达到显著水平;而高浓度SBTI处理中的意大利蜜蜂死亡较多,并在1周后死亡速度加快,第3周时几乎全部死亡。这说明,本研究中所采用的试验方法可以检测出有毒化合物对意大利蜜蜂的致死效应。蜜蜂是一种社会性昆虫,而哺育行为是蜜蜂的一个重要特征。王浆腺是产生王浆和蛋白质的腺体,意大利蜜蜂幼蜂出房后第6天,头部的王浆腺开始发育,并在取食8-10天后,王浆腺腺泡直径发育到最大,第12天时,王浆腺重量达到最大,但是在蜂笼中人工饲养的蜜蜂会小于在蜂巢中的蜜蜂(Pateletal.,1960;Sagilietal.,2005;吴杰,2012)。本研究对取食了10天Cry蛋白的意大利蜜蜂头部进行解剖,并测量了王浆腺腺泡直径。结果显示,Cry2A和Cry1C蛋白对意大利蜜蜂王浆腺腺泡直径没有显著影响。但是浓度为0.1%的SBTI处理的意蜂王浆腺腺泡直径明显减小。Babendreier等分别用浓度为0.0014%的Cry1Ab、浓度为0.1%和1%的SBTI饲喂意大利蜜蜂工蜂后,取食Cry1Ab蛋白的蜜蜂王浆腺发育正常,而取食了两种浓度的SBTI蜜蜂的王浆腺发育受42
中国农业科学院博士学位论文第四章Bt蛋白及Bt花粉对意大利蜜蜂成虫的毒性影响到严重影响,其重量和腺泡直径均明显减小(Babendreieretal.,2005);同时,Sagili等的研究也发现了这一现象,并且发现取食了高浓度的SBTI后,蜜蜂王浆腺内的蛋白含量也明显减少(Sagilietal.,2005)。中肠内含有多种蛋白酶和解毒酶,是昆虫消化吸收的主要场所,也是杀虫蛋白的作用部位。总蛋白酶、类胰蛋白酶、氨肽酶、α-乙酸萘酯酯酶活性通常被用在研究杀虫化合物对昆虫的毒性影响方面。取食了含有Cry2A或Cry1C蛋白的意大利蜜蜂中肠内的总蛋白酶、类胰蛋白酶、氨肽酶、α-乙酸萘酯酯酶的活性均没有显著变化,而SBTI处理中的意大利蜜蜂总蛋白酶和α-乙酸萘酯酯酶活性有明显上升现象,类胰蛋白酶、氨肽酶活性也高于空白对照,但是没有显著性差异。这说明两种Bt蛋白对意大利蜜蜂成蜂中肠内的蛋白酶和解毒酶不产生影响。随后进行了Bt花粉试验,试验中意大利蜜蜂分别取食了两种Bt水稻花粉和相应的非Bt水稻花粉,结果不论是存活率、王浆腺发育,还是中肠主要蛋白酶和解毒酶的活性,都没有发现任一Bt花粉和非Bt花粉处理相比有明显的差异。在研究其它转基因抗虫作物如转基因抗虫玉米和抗虫棉花时,也没有发现相应的Bt花粉如Cry1Ab玉米花粉,Cry1Ac棉花、Cry1Ac+CpTI棉花花粉对意大利蜜蜂的体重、寿命、死亡率、王浆腺及中肠蛋白水解酶活性有任何的影响(Babendreieretal.,2005;Roseetal.,2007;Hanetal.,2010a,2012)。本研究利用生物学、生理生化、组织病理学等手段系统地研究了两种Bt蛋白Cry1C和Cry2A对意大利蜜蜂幼虫的潜在毒性影响。结果证实了意大利蜜蜂幼虫对这两种Cry蛋白不敏感。这一结果与之前的对其它Cry蛋白(Cry1Ac,Cry1Ab,Cry2Ab,Cry3Bb1)的研究结果相吻合(Roseetal.,2007;Duanetal.,2008)。ELISA检测结果显示,利用Cry蛋白或Bt水稻花粉连续饲喂意大利蜜蜂时,意蜂可以取食到相当高浓度的Cry蛋白并在体内残留。另外,两种Cry蛋白及相应Bt水稻花粉杀虫活性已利用敏感昆虫生测试验确定(Lietal,2015)。总结以上结果得出,在实验室水平上,没有发现两种转Bt水稻T2A-1和T1C-19对意大利蜜蜂工蜂的生长发育有影响。43
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响第五章Bt蛋白对意大利蜜蜂肠道微生物的影响昆虫消化系统是微生物的一个重要的栖息地,在长期的进化过程中,这些肠道微生物,它们可能参与昆虫的消化、吸收及繁殖等,与昆虫的生长发育密切相关(田贞华等,2007;Zindeletal.,2013;南春燕等,2013;徐红星等,2014)。肠道内细菌群落可以从个体水平和整体水平上反应蜜蜂的健康状况(MohrandTebbe,2006;Martinsonetal.,2012)。目前大部分研究主要集中在蜜蜂的致病性微生物的方面,也有一些人对蜜蜂肠道内非病原性微生物群落(如共生菌等)及其对蜜蜂生长发育的潜在影响进行了研究,这也说明了人们越来越关注肠道微生物对蜜蜂种群的重要性(Sabreeetal.,2012;Vojvodicetal.,2013)。因此,在评价转基因作物和杀虫蛋白对蜜蜂的安全性时,除了测定蜜蜂存活率、酶活性及王浆腺的发育程度以外,蜜蜂消化道内微生物群落也是一个重要方面。本研究采用变性梯度凝胶电泳(DGGE)以及文库序列分析两种分子生物学手段,对不同饲喂时间的意蜂工蜂肠道细菌群落结构进行了研究。5.1材料方法5.1.1供试昆虫意大利蜜蜂蜂群由中国农业科学院蜜蜂研究所提供。试验前将空脾放入继箱中,蜂王在空脾上产卵24h。待封盖9d后,将封盖子脾放入培养箱中,条件为40±1ºC,RH70±10%,无需光照。将新出房的幼蜂(<24h)放入蜂笼(9×9×10cm)中进行试验。5.1.2供试花粉试验中所用的蜜蜂采集的杂花粉由中国农科院蜜蜂所代平礼老师实验室提供。使用前将花粉磨成粉末,放4ºC冰箱保存直至使用。5.1.3供试试剂Cry1C和Cry2A纯蛋白及相应的ELISA试剂盒均购于Envirotest-China(agentforEnvirologixInc.,Portland,Maine,USA;www.envirotestchina.com)。Cry1C和Cry2A纯蛋白纯度为94-96%,保存在-80ºC冰箱中。ELISA试剂盒保存在4ºC冰箱。5.1.4主要仪器PCR扩增仪(PE2700,PE9700,BiometraTgradient),Real-timePCR检测系统(Chromo4,Bio-Rad),凝胶成像分析系统(ULTRA-LÜMΩMEGA10);电泳仪(PAC1000,Bio-Rad),透射扫描仪(PowerLook1000,Umax),核酸测序仪(ABIPRISM337,3730)。44
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响5.2试验内容5.2.1意大利蜜蜂的饲喂(1)意大利蜜蜂幼虫肠道取样:试验设4个处理:1)不加任何其它化合物纯人工饲料(空白对照);2)含Cry2A的饲料,浓度为400µg/gFW;3)含Cry1C蛋白的饲料,浓度为50µg/gFW;4)含SBTI的人工饲料,浓度为1mg/gFW。饲养配制同2.2.1所述,然后按照2.2.2所述进行饲喂,喂养4天后取样。用昆虫针将虫体两端固定住,用解剖剪剪开腹部,并用镊子将肠道取出,放在1.5mL离心管中,每管放5头幼虫的肠道,每个处理3个重复,使用前样品保存在-20ºC冰箱。(2)意大利蜜蜂成虫中肠取样:随机抓取新出房的工蜂放入自制养蜂笼(9×9×10cm)中,每笼30头。蔗糖水和杂花粉粉末分别盛放在自制容器中饲喂给蜜蜂,同4.2.1。每笼每天提供2mL糖水,和足够量的杂花粉粉末。试验共设4个处理:1)50%蔗糖水,作为空白对照;2)Cry2A浓度为400µg/g;3)Cry1C浓度为50µg/g;4)SBTI浓度为1mg/g。并按第四章所述方法进行饲喂。每个处理分别在第5天,第10天和第15天取样。每个处理取30头工蜂进行解剖,即3个重复。在冰浴上用镊子镊住工蜂尾针后将整个肠道拉出,然后将中肠和后肠分离后分别放入1.5mL离心管中,每管10头成蜂中肠。取出的中肠立即放置在-20ºC冰箱保存。5.2.2样品DNA的提取及检测样品DNA采用美国Mo-Bio试剂盒提取,操作步骤按试剂盒内说明书进行。提取出的DNA样品立即放入-20ºC冰箱保存。提取的DNA样品质量通过0.7%琼脂糖凝胶电泳进行检测。基因组Marker采用λ-HindⅢ(大连宝生物)。5.2.3PCR扩增(1)16srDNAV3区所用引物序列为:338F:5`-ACTCCTACGGGAGGCAGCAG-3`534R-GC:5`-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGG(ATTACCGCGGCTGCTGG)-3`。(2)50µLPCR反应体系包括:10×PCRBuffer5µL;2.5mM的dNTPMixture4µL;20µM的引物338F1µL;20µM引物534R1µL;模板DNA2.5ng;5U/µLTaKaRarTaq0.25µL;最后用ddH2O补至50µL。(3)PCR扩增程序如下:45
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响首先94ºC预变性10min,然后94ºC变性1min,55ºC退火1min(每个循环降低0.1ºC),72ºC延伸1min30s,共30个循环,最终72ºC延伸10min。5.2.4DGGE图谱分析(1)DGGE电泳条件:采用8%丙烯酰胺胶,变性范围为30-60%,在150V电压下电泳7h。丙烯酰胺胶配方如表5.1。制备胶板时分别加入200µlAPS(10%的过硫酸铵)和20µlTEMED。表5.1丙烯酰胺胶配方Table5.1FormulationofAcrylamidegel药品名称30%60%40%丙烯酰胺4mL4mL50×TAE0.4mL0.4mL尿素2.52g5.04g去离子甲酰胺2.4mL4.8mLddH2O定容至20mL20mL(2)银染及扫描出图:电泳结束后进行银染。步骤如下:其中硫代硫酸钠初始浓度为100mg/mL1)固定:采用10%的乙酸进行固定。取450mL纯水,加入50mL冰醋酸,混合均匀。然后将其倒入容器中固定30min,中间摇晃数次。2)水洗三次,每次2min。3)染色:采用0.1%的AgNO3染色。取0.4gAgNO3加入400mL纯水中,再加入甲醛400µL,轻摇25min。4)水洗20s。5)显色:用20%的Na2CO3显色。取12.5gNa2CO3加500mL去离子水,加入甲醛500µL,Na2S2O3100µL。6)10%乙酸终止反应30min。7)重新水洗2h。8)染色后的凝胶用透射扫描仪UMAXPowerLook1000扫描获取胶图。(3)图谱分析:DGGE图谱通过Gel-ProAnalyzer等软件进行分析。聚类分析采用Phylip4.0软件计算分离度,并采用Mega3.1分析出图。46
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响(4)多样性指数分析:香农-维纳指数(Shannon-Winnerindex)用来反映微生物群落的多样性。其计算公式为:H=-∑(Pi)(log2Pi)(公式5.1)其中,H=群落的多样性指数,S=总的物种数,Pi=样品中属于第i种个体的比例=ni/N。物种均一度(Evenness)用来表示群落中不同类群分布的均匀程度。公式为:E=H/InS’(公式5.2)其中H为香农指数,S’为每条泳道的条带数。5.2.516SrRNA基因文库与测序(1)DGGE条带回收及PCR扩增:DEEG凝胶上同一水平只切一条带进行回收。PCR扩增试验条件与操作步骤同4.2.2。(2)克隆与测序:将16SrRNA基因PCR扩增产物进行纯化,后与pMD19-T载体连接。每个条带随机挑取3个阳性克隆进行测序。测序引物为M13F(-47)。测序结果在NCBI数据库中进行序列比对。系统进化发育分析树利用MEGA5.0生成。5.3结果分析5.3.1意大利蜜蜂幼虫肠道细菌群落结构检测5.3.1.1DNA提取结果及PCR扩增结果图5.1与图5.2分别为意大利蜜蜂幼虫肠道细菌基因组DNA提取结果与PCR扩增结果。两个图中的点样顺序一致,从左至右为依次为:M为Marker,1-3为纯人工饲料处理,4-5为Cry2A蛋白处理,7-8为Cry1C蛋白处理,10-12为SBTI处理。Marker上数第一条带为23kb,出现在其略靠下的位置的条带一般认为是基因组DNA。从图5.1中可以看出,所提取的基因组DNA电泳条带均一、清晰、明亮,没有出现拖尾和弥散现象。图5.2中Marker自上而下对应已知片段大小为2000,1000,750,500,250,100bp。引物采用16SrRNA对应通用引物338F-534R,图中所示PCR产物在250bp位置,判断为目的片段。扩增结果特异性较好。47
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响图5.1意大利蜜蜂幼虫肠道细菌基因组提取结果Figure5.1ImageofelectrophoresisofbacterialgenomeofA.melliferaligusticalarvaefor4daysexposureofpurediet,Cry1Cat50µg/gdiet,Cry2Aat400µg/gdiet,orSBTIat1mg/gdiet图5.2意蜂幼虫肠道细菌基因组PCR扩增结果Figure5.2PCRamplificationresultofbacterialgenomeofA.melliferaligusticalarvaefor4daysexposureofpurediet,Cry1Cat50µg/gdiet,Cry2Aat400µg/gdiet,orSBTIat1mg/gdiet5.3.1.2DGGE图谱分析结果图5.3中B1-B11为条带编号,DGGE指纹图谱可以直观地看出所有样品之间条带数有所不同,都有相似的优势条带,所有样品的共同条带为B3、B6、B8、B9,但条带的信号强度有所不同。所有处理的平均条带数在12-15之间。从聚类分析图可以看出,所有样品可以分成两大类,其中Cry2A及Cry1C处理的所有样品与纯人工饲料处理中的其中两个样品相似性较高,聚为一类,SBTI处理的各样品与空白对照处理的一个样品为另一类(图5.3)。Cry2A蛋白、Cry1C蛋白处理与空白对照相比,香农-维纳指数(Shannon-Winnerindex)和均一度(Evenness)均没有显著性差异(Dunnetttest,P>0.05;表5.2)。SBTI处理的意大利蜜蜂幼虫肠道内细菌群落香农-维纳指数和均一度均高于空白对照处理,但是没有达到显著水平(Dunnetttest,P>0.05;表5.2)。48
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响表5.2意大利蜜蜂幼虫肠道细菌群落多样性指数Table5.2ThediversityindexofgutsbacterialcommunitiesofA.melliferaligusticalarvaefor4daysexposureofpurediet,Cry1Cat50µg/gdiet,Cry2Aat400µg/gdiet,orSBTIat1mg/gdiet处理香农-维纳指数均一度纯人工饲料2.38±0.070.91±0.00Cry2A400µg/g2.33±0.070.93±0.02Cry1C50µg/g2.37±0.040.92±0.02SBTI1mg/g2.54±0.020.95±0.01图5.3意蜂幼虫肠道细菌群落DGGE图谱及聚类分析结果Figure5.3ImageofDEEGprofileandclusteranalysisofmidgutsbacterialcommunitiesofA.melliferaligusticalarvaefor4daysexposureofpurediet,Cry1Cat50µg/gdiet,Cry2Aat400µg/gdiet,orSBTIat1mg/gdiet5.3.1.3DGGE图谱条带克隆测序结果分析通过对DGGE胶中的优势条带切胶回收,克隆测序结果可以看出图谱中的一个条带通常不是由一种微生物组成(表5.3)。测序比对分析得出,在所测的22条序列中,有59.1%的序列与变形菌门Proteobacteria细菌相似性较高(36.4%α-,4.5%β-,18.2%γ-),13.6%序列与厚壁菌门Firmicutes相似性较高,其余为未知细菌。各处理的意大利蜜蜂幼虫肠道细菌群落组成结构相似,Cry2A、Cry1C、SBTI处理与空白对照相比,幼虫肠道内细菌相同类群之间差异水平均不显著(Dunnetttest,P>0.05;图5.4)。49
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响图5.4意大利蜜蜂幼虫肠道细菌类群分布Fig.5.4PhyladistributionofbacteriainmidgutsofA.melliferaligusticalarvaefor4daysexposureofartificialdietscontainingnotoxin(Purediet),Cry1Cat50µg/gdiet,Cry2Aat400µg/gdiet,orSBTIat1mg/gdiet50
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响表5.3意大利蜜蜂幼虫肠道菌群DGGE图谱优势条带序列Table5.3SequencesofpredominantDGGEbandsofgutbacteriacommunitiesinA.melliferaligusticalarvae条带编号克隆子编号登录号NCBI比对结果分类相似性%1-1KM603630.1Novosphingobiumaromaticivoransα-Proteobacteria9911-2FJ534652.1Bradyrhizobiumsp.α-Proteobacteria991-3GU301189.1UnculturedbacteriumUnknown10022-1KF424830.1Psychrobacternivimarisγ-Proteobacteria993-1HG518621.1UnculturedbacteriumUnknown9833-2KF424830.1Psychrobacternivimarisγ-Proteobacteria983-3HG518620.1UnculturedbacteriumUnknown994-1GU226320.1SolibacillussilvestrisFirmicutes10044-2LK391665.1Psychrobacterfoziiγ-Proteobacteria1005-1KM652209.1Vibrioatlanticusγ-Proteobacteria10055-2AB201254.1Sphingomonasmelonisα-Proteobacteria1005-3KM658469.1Sphingomonasfaeniα-Proteobacteria10066-1HG518621.1UnculturedbacteriumUnknown1007-1AB201254.1Sphingomonasmelonisα-Proteobacteria10077-2NR118912.1SporosarcinaglobisporaFirmicutes997-3KM365348.1Acetobacteraceaebacteriumα-Proteobacteria9988-1KM658469.1Sphingomonasfaeniα-Proteobacteria1009-1KM018209.1Bradyrhizobiumsp.α-Proteobacteria10099-2KM264321.1Rhodopseudomonaspalustrisα-Proteobacteria9910-1KM264321.1RhodopseudomonaspalustrisUnknown991010-2HM631837.1BacilluslicheniformisFirmicutes10010-3J778652.1Eoetvoesiasp.β-Proteobacteria951111-1HG518621.1UnculturedbacteriumUnknown995.3.2意大利蜜蜂成虫中肠细菌群落结构检测5.3.2.1DNA提取结果及PCR扩增结果图5.5和图5.6中分别为意大利蜜蜂成虫中肠细菌基因组DNA提取结果与PCR扩增结果。两个图中的点样顺序一致。Marker上数第一条带为23kb,出现在其略靠下的位置的条带一般认为是基因组DNA。图5.5显示所提取的基因组DNA电泳条带均一、清晰、明亮,没有出现拖尾和弥散现象。图5.6所示PCR产物在250bp位置,判断为目的片段。51
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响图5.5意大利蜜蜂成虫中肠基因组DNA提取结果Figure5.5ImageofelectrophoresisofbacterialgenomeofA.melliferaligusticaadultsA:第5天;B:第10天;C:第15天M:Marker;1-3:纯人工饲料;4-5:400µg/gCry2A,7-8:50µg/gCry1C;10-12:1mg/gSBTI图5.6第5天意蜂成虫中肠基因组PCR扩增结果Figure5.6PCRamplificationresultsofbacterialgenomeofA.melliferaligusticaadultsA:第5天;B:第10天;C:第15天M:Marker;1-3:纯人工饲料;4-5:400µg/gCry2A,7-8:50µg/gCry1C;10-12:1mg/gSBTI52
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响5.3.2.2DGGE图谱分析结果图5.7中DGGE图谱中的阿拉伯数字标注的是主要条带编号。DGGE图谱显示:不同处理之间,饲喂相同天数的意大利蜜蜂成虫中肠样品有相似的优势条带,但条带的信号强度有所不同;饲喂天数不同,意大利蜜蜂中肠样品的优势条带数有所不同(图5.7)。从聚类分析图可以看出,饲喂相同天数的不同处理样品间具有较高的相似性;饲喂5天后的样品可以分成两类,S12单独一类,其它所有样品为一类;第10天的样品除S14和S24为同一类外,其它样品分成一类;第15天的样品S34,S35和S36相似性较高聚为一类(图5.7)。Cry2A蛋白、Cry1C蛋白、SBTI处理与空白对照相比,分别在第5天,第10天和第15天的中肠细菌群落的香农-维纳指数在2.10-2.60之间,均一度都大于0.86,并且没有显著性差异(Dunnetttest,P>0.05;表5.4)。表5.4意大利蜜蜂成虫中肠细菌群落多样性指数Table5.4ThecommunitystructureofbacterialfromA.melliferaligusticaadultsmidgutsShannon-WinnerindexEvenness处理5d10d15d5d10d15d纯糖水2.39±0.182.40±0.142.31±0.070.88±0.050.86±0.030.91±0.03Cry2A(400µg/g)2.27±0.162.49±0.082.17±0.040.90±0.020.86±0.020.92±0.02Cry1C(50µg/g)2.43±0.042.39±0.022.39±0.080.88±0.010.87±0.000.92±0.01SBTI(1mg/g)2.32±0.102.28±0.032.53±0.030.89±0.020.92±0.010.95±0.0053
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响图5.7意蜂成虫中肠细菌群落DGGE图谱与聚类分析结果Figure5.3ImagesofDEEGprofileandclusteranalysisofmidgutsbacterialcommunitiesofA.melliferaligusticaadultsA:第5天;B:第10天;C:第15天S1-S3,S13-S15,S25-S27:纯糖水;S4-S5,S16-S18,S28-S30:400µg/gCry2A;S7-S8,S19-S21,S31-S33:50µg/gCry1C;S10-S12,S22-S24,S34-S36:1mg/gSBTI54
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响5.3.2.3DGGE图谱条带克隆测序结果分析对DGGE图谱中所有编号的条带进行回收,每一水平上的条带选择一个条带进行3次克隆,测序并进行序列比对,结果如表5.5、表5.6和表5.7,图谱中的一个条带并不是由一种微生物组成的。表5.5中,所测48条序列中有62.5%的序列与变形菌Proteobacteria有较高的同源性(27.1%α-,12.5%β-,22.9%γ-),16.7%序列与厚壁菌门Firmicutes相似性较高,2.1%与放线菌Actinobacteria有较高的同源性,其余为未知菌种;表5.6中,所测45条序列中有55.6%与变形菌有较高的同源性(22.2%α-,15.6%β-,17.8%γ-),13.3%序列与厚壁菌门相似性较高,4.4%与放线菌有较高的同源性;表5.7中,所测30条序列中有70%与变形菌有较高的同源性(20%α-,23.3%β-,26.7%γ-),23.3%序列与厚壁菌门相似性较高。从表5.8中可以看出,变形菌门在所有处理中均有;第10天SBTI处理中蜜蜂中肠中没有厚壁菌门和放线菌;第15天时,4个处理中蜜蜂中肠内不含放线菌。表5.5取食5天后意大利蜜蜂成虫肠道菌群DGGE图谱优势条带序列Table5.5SequencesofpredominantDGGEbandsofgutbacteriacommunitiesinA.melliferaligusticaadultsfor5-dayexposure条带编号克隆子编号登录号NCBI比对结果分类相似性%1-1KM068134.1LactobacillusapisFirmicutes9711-2KM068137.1Frischellaperraraγ-Proteobacteria961-3KM068133.1LactobacillushelsingborgensisFirmicutes9822-1HM112068.1CandidatusGilliamellaapicolaγ-Proteobacteria993-1KJ853606UnculturedbacteriumcloneUnknown9933-2JQ046823.1UnculturedbacteriumcloneUnknown1003-3KF101700UnculturedbacteriumcloneUnknown974-1JN713428.1Xenophilussp.β-Proteobacteria9744-2JN585337.1Comamonadaceaebacteriumβ-Proteobacteria975-1KM362893.1Psychrobactersp.γ-Proteobacteria10055-2KM888123.1BacillusmegateriumFirmicutes1005-3KJ720680.1Pseudomonassp.γ-Proteobacteria966-1KJ372236.1LysinibacillussphaericusFirmicutes10066-2LN650466.1BacillusaryabhattaiFirmicutes1006-3KM505011.1BacillusflexusFirmicutes977-1JQ673256.1Betaproteobacteriumβ-Proteobacteria9977-2KJ850435.1Saccharibacterfloricolaα-Proteobacteria1008-1KM253232.1Sphingomonassp.α-Proteobacteria10088-3NR_122055.1Snodgrassellaalviβ-Proteobacteria9899-1KM365348.1Acetobacteraceaebacteriumα-Proteobacteria10055
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响9-2KF356458.1Novosphingobiumsp.α-Proteobacteria989-3HM113226.1CandidatusSnodgrassellaalviβ-Proteobacteria98表5.5取食5天后意大利蜜蜂成虫肠道菌群DGGE图谱优势条带序列(续)10-1KM070563.1Acinetobactertowneriγ-Proteobacteria1001010-2KJ734993.1BacteriumM1(2014)Unknown10011-1LN614535.1Enterobactersp.γ-Proteobacteria991111-2KC413915.1UnculturedbacteriumUnknown9912-4AJ971906.1Saccharibactersp.α-Proteobacteria991212-2KM051081.1PaenibacilluspolymyxaFirmicutes9812-3AJ583164.1Unculturedalpha-proteobacteriumα-Proteobacteria9913-1KM501029.1UnculturedbacteriumcloneUnknown1001313-2JQ389885.1UnculturedAcetobacteraceaebacteriumα-Proteobacteria10014-1KF816550.1MarinebacteriumUnknown1001414-2KJ728994Sphingomonasglacialisα-Proteobacteria8614-3KM019861.1Novosphingobiumbarchaimiiα-Proteobacteria1001515-1KM275672.1Cronobactersakazakiiγ-Proteobacteria1001616-1KF928789.1Salmonellaentericaγ-Proteobacteria991717-1KF101700.1UnculturedbacteriumcloneUnknown10018-1KJ011877.1Moraxellapluranimaliumγ-Proteobacteria1001818-2KM373171.1Afipiasp.α-Proteobacteria10018-3KF437548.1Alphaproteobacteriumα-Proteobacteria9919-1LM994802.1Sphingomonasaurantiacaα-Proteobacteria991919-2HM113257.1UnculturedBacillibacteriumFirmicutes9919-3JQ046772.1UnculturedbacteriumcloneUnknown9820-1KM019826.1Enterobacterludwigiiγ-Proteobacteria1002020-2KJ733978.1Pantoeasp.γ-Proteobacteria9721-1KM253169.1Sphingopyxissp.α-Proteobacteria992121-2KM396916.1Microbacteriumsp.Actinobacteria1002222-1KC866183.1Kingelladenitrificansβ-Proteobacteria9556
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响表5.6取食10天后意大利蜜蜂成虫肠道菌群DGGE图谱优势条带序列Table5.6SequencesofpredominantDGGEbandsofgutbacteriacommunitiesinA.melliferaligusticaadultsfor10-dayexposure条带编号克隆子编号登录号NCBI比对结果分类相似性%1-1KF600122.1Gilliamellaapicolaγ-Proteobacteria10011-2KF599360.1Snodgrassellaalviβ-Proteobacteria981-3FJ204470.1GroundwaterplanktonicbacteriumUnknown832-1HM112068.1CandidatusGilliamellaapicolaγ-Proteobacteria9822-2KM365407.1LactobacilluskunkeeiFirmicutes10033-1KF923424.1Sphingomonasechinoidesα-Proteobacteria9944-1GU301189UnculturedbacteriumUnknown1005-1HM112111.1CandidatusSnodgrassellaalviβ-Proteobacteria10055-2KM019826.1Enterobacterludwigiiγ-Proteobacteria995-3KJ372038.1Sphingobiumsuberifaciensα-Proteobacteria986-1JQ673256.1Betaproteobacteriumβ-Proteobacteria9966-2KJ495787.1BacteriumH8(2014)Unknown1007-1KJ013312UnculturedbacteriumUnknown9977-2KM409665.1Lactococcussp.Firmicutes10088-1JX896592.1Neisseriaceaebacteriumβ-Proteobacteria9799-1KM888110.1BrevibacteriumhalotoleransstrainFirmicutes9910-1HQ891390.1UnculturedbacteriumcloneUnknown1001010-2HG518583UnculturedbacteriumUnknown10010-3HG518617CephisussiccifoliusUnknown9711-1KC632208.1Kingelladenitrificansβ-Proteobacteria961111-3KF554246.1Eikenellacorrodensβ-Proteobacteria931212-1KC236878.1Bacillussp.Firmicutes991313-1KM365348.1Acetobacteraceaebacteriumα-Proteobacteria1001414-1LM994802.1Sphingomonasaurantiacaα-Proteobacteria9915-1KF540261.1Sphingopyxissp.α-Proteobacteria991515-2KJ850435.1Saccharibacterfloricolaα-Proteobacteria991616-1KF600210.1Gammaproteobacteriumγ-Proteobacteria9917-1KM434224.1Klebsiellasp.γ-Proteobacteria1001717-3KM068134.1LactobacillusapisFirmicutes951818-1KM253194.1Serratiasp.γ-Proteobacteria9919-1AB669255.1UnculturedBacteroidetesbacteriumBacteroidetes991919-2KC442379.1Arthrobactersp.Actinobacteria9819-3FJ534652.1Bradyrhizobiumsp.α-Proteobacteria1002020-1JX473565.1SynergistetesbacteriumSynergistetes982121-1KM459023.1Clostridiumsp.Firmicutes10057
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响表5.6取食10天后意大利蜜蜂成虫肠道菌群DGGE图谱优势条带序列(续)2222-1NR_122055.1SnodgrassellaalvistrainwkB2β-Proteobacteria9623-1KM281504.1Acinetobacterjuniiγ-Proteobacteria982323-2LN614635.1Rhodococcussp.Actinobacteria10023-3AJ971906.1Saccharibactersp.α-Proteobacteria10024-1KM362893.1Psychrobactersp.γ-Proteobacteria1002424-2KC820018.1UnculturedbacteriumcloneUnknown9925-1HG518618UnculturedbacteriumUnknown1002525-3KM068137.1Frischellaperraraγ-Proteobacteria9826-1AF431109.1Unculturedalphaproteobacteriumα-Proteobacteria1002626-2HE662817.1Stakelamapacificaα-Proteobacteria9926-3HG518583UnculturedbacteriumUnknown10058
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响表5.7取食15天后意大利蜜蜂成虫肠道菌群DGGE图谱优势条带序列Table5.7SequencesofpredominantDGGEbandsofgutbacteriacommunitiesinA.melliferaligusticaadultsfor15-dayexposure条带编号克隆子编号登录号NCBI比对结果分类相似性%11-1KM365407.1LactobacilluskunkeeiFirmicutes1002-1KM365407.1LactobacilluskunkeeiFirmicutes9922-3KM068137.1Frischellaperraraγ-Proteobacteria9933-1KM365407.1LactobacilluskunkeeiFirmicutes10044-1JQ581699.1Unculturedgammaproteobacteriumγ-Proteobacteria9955-1KF599360.1Snodgrassellaalviβ-Proteobacteria10066-1JQ405140.1Unculturedbetaproteobacteriumβ-Proteobacteria9977-1KF600162.1Lactobacillussp.Firmicutes1008-1KM199276.1BacillusatrophaeusFirmicutes9988-2HM112111.1CandidatusSnodgrassellaalviβ-Proteobacteria1008-3HQ161398.1UnculturedAlcanivoraxsp.γ-Proteobacteria909-1AB201254.1Sphingomonasmelonisα-Proteobacteria10099-2KF699895.1BacillussafensisFirmicutes991010-1JX896587.1Neisseriaceaebacteriumβ-Proteobacteria971111-1KC866183.1Kingelladenitrificansβ-Proteobacteria961212-1HG518618UnculturedbacteriumUnknown9913-1KF554246.1Eikenellacorrodensβ-Proteobacteria951313-2KM365348.1Acetobacteraceaebacteriumα-Proteobacteria1001414-1KJ850435.1Saccharibacterfloricolaα-Proteobacteria1001515-1KM019826.1Enterobacterludwigiiγ-Proteobacteria10016-1KJ495787.1BacteriumH8(2014)Unknown991616-2EF187243.1LactobacillusmelliventrisFirmicutes9816-3KF668471.1Gibbsiellasp.γ-Proteobacteria981717-1GQ487566.1Serratiasp.γ-Proteobacteria10018-1KM487651.1Salmonellaentericasubsp.γ-Proteobacteria1001818-3AB975352.1Kosakoniaarachidisγ-Proteobacteria9619-1KF260987.1Azospiraoryzaeβ-Proteobacteria981919-2FJ534652.1Bradyrhizobiumsp.α-Proteobacteria10020-1KF246578.1Gluconobacterthailandicusα-Proteobacteria1002020-2KM114861.1Rhizobiumlupineα-Proteobacteria10059
,Cry2ASBTI天0015第Cry2ACry1C蛋白对意大利蜜蜂肠道微生物的影响Bt第五章纯糖水23.28±2.6015.74±7.91022.88±1.0820.00±0.000SBTI天10第。orSBTIat1mg/gdietCry2ACry1C,1mg/gdiet浓度为纯糖水SBTIat400µg/gdiet;adultsfordifferentdaysexposureofartificialdietscontainingnotoxin(Purediet),Cry1Cat50µg/gdiet400µg/g取食不同天数不同处理的意大利蜜蜂成虫肠道细菌类群分布ligusticaSBTI5.8浓度为表Cry2AA.mellifera;天5µg/gdiet第50Cry2ACry1C。浓度为%Cry1C;,单位为±SE纯糖水22.51±1.9825.11±3.4615.48±3.4011.47±8.1727.76±3.2733.93±5.3521.28±2.4130.52±6.4016.43±2.5812.54±7.5525.24±4.6024.33±2.3310.45±0.8912.55±1.7318.33±0.8620.90±1.7722.58±2.9821.89±2.6230.63±1.4131.17±2.603.97±0.2012.57±0.8712.70±5.1916.57±2.0118.33±1.6724.05±0.5032.90±2.8121.87±4.3218.98±7.191.1926.31±0.3119.16±3.138.79±2.3315.08±0.794.76±2.3824.09±2.1511.57±6.4324.67±6.8113.33±0.007.44±2.9621.43±0.8218.48±4.6016.34±2.9940.00±0.0021.20±2.7434.72±1.391.113.48±0.3323.70±1.8723.89±2.0023.48±6.7320.00±0.001.4525.24±1.6731.17±2.6009.56±2.063.12±1.5718.98±7.195.22±0.7812.63±0.926.67±0.005.08±1.11050%(w:w)Phyladistributionofbacteriainmidgutsof表内数值为平均值纯糖水浓度为1)2)-Proteobacteria-Proteobacteria-ProteobacteriaTable5.8分类αβγFirmicutesActinobacteria其它中国农业科学院博士学位论文注:60
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响5.5讨论研究转基因作物对非靶标生物的潜在影响,不仅仅局限在研究其对非靶标生物的生物学或病理学方面。以分子手段研究转基因作物对非靶标生物体内微生物群落结构已经成为非靶标影响研究中的一个重要方面。到目前为止,已有许多转基因作物风险评估工作者研究了转基因作物对非靶标节肢动物肠道细菌多样性的影响,其中也包括了对蜜蜂的研究(Disayathanoowatetal.,2012;Gengetal.,2013;Jiangetal.,2013)。本研究是利用PCR-DGGE技术分析了两种Bt蛋白Cry1C和Cry2A在高浓度下是否会引起意大利蜜蜂幼虫及不同日龄成虫中肠内细菌群落结构的变化。DGGE图谱直观地显示了各处理中条带的多少,其中幼虫肠道处理条带数最少,说明细菌群落结构相对简单,细菌种类较少,这可能与意大利蜜蜂幼虫的生长方式有关,因为意大利蜜蜂幼虫没有主动取食的能力,只能依靠哺育蜂饲喂,其食物主要是王浆,而王浆中含有拟菌肽成份,并且幼虫与外界环境鲜有接触。意大利蜜蜂成虫DGGE图谱显示了相对较多的优势条带,说明成虫中肠内的细菌群落相对复杂。不论是意大利蜜蜂幼虫还是成虫,两种Cry蛋白、SBTI与对照处理之间均有较高的相似性,而且每个处理的香农-维纳指数及其衍生出的均一度指数也不存在显著性差异。这与之前研究Bt棉花花粉对意大利蜜蜂工蜂肠道细菌群落结果相一致,姜玮瑜等利用PCR-DGGE技术研究了转cry1Ac基因棉(SGK321)对意大利蜜蜂肠道细菌的影响,通过DEEG图谱分析并没有发现不同处理之间细菌群落组成有明显差异,并且利用PCR也没有检测到外源DNA整合到蜜蜂肠道微生物的基因组中。并且,随着饲喂天数的增加,意大利蜜蜂成虫中肠细菌群落的多样性指数也没有显著性差异(姜玮瑜等,2010;Gengetal.,2013)。序列比对结果显示,意大利蜜蜂肠道内细菌的优势种群为变形菌门Proteobacteria、厚壁菌门Firmicutes,并且变形菌门占较大比例。变形菌门可分为三大类:α-,β-,γ-变形菌,厚壁菌门则主要是由乳杆菌Lactobacillussp.组成。另外,还有一部份为未知菌种。之前的一些研究也得出了相似的结果(MohrandTebbe,2006;Babendreieretal.,2007;Cox-Fosteretal.,2007;Disayathanoowatetal.,2012;Martinsonetal.,2012;Moranetal.,2012;Bourtzisetal.,2013)。并有研究推断,意大利蜜蜂成虫体内的细菌主要是通过取食蜂王浆、蜂蜜及花粉获得,面幼虫体内的细菌可能是通过哺育蜂的饲喂蜂蜜而获得的(Vojvodicetal.,2013)。在取食了Cry2A、Cry1C蛋白或者0.1%的SBTI后,意大利蜜蜂幼虫肠道内主要菌群没有发生明显的变化。随着饲喂天数的增加,意大利蜜蜂成虫体内菌群结构有所变化:第5天时,所有处理的成虫体内细菌种类除了共同拥有的变形菌和厚壁菌外,还有一小部分放线菌;第10天时,SBTI处理的蜜蜂体内则少了放线菌和厚壁菌;第15天时,所有处理的成虫体内没有放线菌。这说明,在意大利蜜蜂成长过程中,其肠道内的细菌群落结构并不是一层不变的,会随着时间的推移而波动。这可能与蜜蜂的取食和发育状态不同有关。在取食了10天SBTI后,导致了蜜蜂中肠内可培养细菌种类减少,这与Babendreier等的研究结果相似,该研究利用T-RFLP和PCR技术发现取食了高浓度SBTI的蜜蜂中肠内T-RFs数量显著减少(Babendreieretal.,2007)。总体上来看,意大利蜜蜂成虫在第10天左右时,其生长发育可能容易受外界环境如食物等的影响。本研究中所采用的PCR-DGGE技术被广泛应用于微生物群落结构研究中,其优点是可以直61
中国农业科学院博士学位论文第五章Bt蛋白对意大利蜜蜂肠道微生物的影响观地可以对条带进行切胶回收并测序,从而得到各条带的序列信息,然后通过序列比对可以对微生物进行分类。而这种方法也存在一些不足:在对条带进行回收测序时,容易产生误差;所提供检测的DNA片段在200bp左右,可供测序的碱基数较少;序列比对的结果有一部分是未知菌株,针对性较差(Nakatsuetal.,2000;罗海峰等,2003;马悦欣等,2003;孙宝盛等,2008;孙庆华等,2009)。从目前的研究结果来看,在人工饲料条件下持续取食高剂量的Cry2A或Cry1C蛋白并不会对意大利蜜蜂幼虫肠道细菌群落的结构产生较大的影响。62
中国农业科学院博士学位论文第六章全文总结第六章结论6.1结论蜜蜂作为一种非常重要的经济和生态昆虫,对自然界做出了巨大贡献。在我国,意大利蜜蜂是重要的蜜蜂品种之一,其以植物花粉为主要食物,同时也采集植物花蜜和蚜虫或其它昆虫分泌的蜜露。转基因植物的种植,使其在取食过程中可能直接接触到转基因抗虫植物表达的外源杀虫蛋白,如Bt蛋白。意大利蜜蜂以其本身的经济和生态价值,一直作为重要的指示性物种用于杀虫剂和转基因抗虫植物环境安全评估中(Malone,2002;Babendreieretal.,2004,2005;Bakeretal.,2012;Crailsheimetal.,1990;Niuetal.,2013)。本研究主要从不同角度系统地研究了两种转基因抗虫水稻品系T2A-1和T1C-19对意大利蜜蜂幼虫及成虫的潜在毒性影响。得出以下结果:(1)基于国际上报道的意大利蜜蜂幼虫人工饲料,发展了一种简单灵敏的检测胃毒性杀虫剂或转基因杀虫蛋白对意大利蜜蜂幼虫直接毒性影响的检测方法。该方法通过把受试杀虫化合物均匀地混入人工饲料中直接饲喂给意大利蜜蜂幼虫,并以加入浓度为0.1%(w:w)大豆胰蛋白酶抑制剂SBTI的人工饲料为阳性对照,以纯人工饲料为空白对照,通过比较分析处理组和对照组意蜂幼虫存活率、发育历期、预蛹体重和羽化率等重要生命指标测定受试杀虫化合物对意蜂幼虫的潜在毒性。利用本方法测定了不同浓度SBTI对意蜂幼虫的毒性,结果显示:意蜂幼虫不同生命表参数与饲料中SBTI的浓显示出明显的剂量-效应关系,这说明了该方法的有效性和灵敏性。(2)利用上述检测方法,分别从生物学、生理生化、组织病理学等手段系统地研究了Cry2A及Cry1C蛋白对意大利蜜蜂幼虫的毒性影响。结果证实了意大利蜜蜂幼虫对这两种Cry蛋白不敏感。取食含有Cry2A及Cry1C蛋白的人工饲料后,意蜂幼虫生长发育并没有受到影响;肠道内总蛋白酶、类胰蛋白酶、氨肽酶、α-乙酸萘酯酯酶活性均没有明显变化;没有发现取食了两种Bt蛋白后的意蜂幼虫肠膜受到破坏,肠壁细胞发生裂解的现象。(3)利用现有的意大利蜜蜂工蜂幼虫人工饲喂方法评价了两种转基因抗虫水稻品系T2A-1和T1C-19花粉对意大利蜜蜂幼虫的潜在毒性。结果意大利蜜蜂幼虫可以取食到相当浓度的Bt蛋白,但其生长发育并没有受到影响;肠道中主要蛋白酶和解毒酶活性发生了一定变化,但是这些变化并不足以影响幼虫的表观发育情况。(4)在Bt蛋白试验中,利用50%的蔗糖溶液为载体,将两种Cry蛋白以相当高地浓度提供给意大利蜜蜂。其中Cry2A蛋白浓度为400µg/g,Cry1C浓度为50µg/g,试验结果显示,在持续取食了5周高浓度的Cry2A和Cry1C蛋白后,意大利蜜蜂的存活率并没有受到显著影响。Cry2A和Cry1C蛋白对意大利蜜蜂王浆腺腺泡直径没有显著影响,但是浓度为0.1%的SBTI处理的意蜂王浆腺腺泡直径明显减小。取食了含有Cry2A或Cry1C蛋白的意大利蜜蜂中肠内的总蛋白酶、类胰蛋白酶、氨肽酶、α-乙酸萘酯酯酶的活性均没有显著变化,而SBTI处理中的意大利蜜蜂总蛋白酶和α-乙酸萘酯酯酶活性有明显上升现象,类胰蛋白酶、氨肽酶活性也高于空白对照,但是没有显著性差异。63
中国农业科学院博士学位论文第六章全文总结(5)随后进行了Bt花粉试验,试验中意大利蜜蜂分别取食了两种Bt水稻花粉和相应的非Bt水稻花粉,结果不论是存活率、王浆腺发育,还是中肠主要蛋白酶和解毒酶的活性,都没有发现任一Bt花粉和非Bt花粉处理相比有明显的差异。(6)本研究是利用PCR-DGGE技术分析了两种Bt蛋白Cry1C和Cry2A在高浓度下是否会引起意大利蜜蜂幼虫及不同日龄成虫中肠内细菌群落结构的变化。结果发现,意蜂幼虫肠道内细菌群落结构相对简单;意大利蜜蜂肠道内细菌的优势种群为变形菌门Proteobacteria、厚壁菌门Firmicutes,并且变形菌门占较大比例。变形菌门可分为三大类:α-,β-,γ-变形菌,厚壁菌门则是由乳杆菌Lactobacillussp.组成;不论是意大利蜜蜂幼虫还是成虫,Cry2A和Cry1C蛋白与纯糖水处理相比,肠道内细菌群落多样性指数不存在显著性差异;在人工饲料条件下持续取食高剂量的Cry2A或Cry1C蛋白并不会对意大利蜜蜂肠道细菌群落的结构产生较大的影响。6.2创新点(1)发展了一种简单灵敏的检测胃毒性杀虫剂或转基因杀虫蛋白对意大利蜜蜂幼虫直接毒性影响的检测方法。(2)首次研究了两种转基因抗虫水稻品系T2A-1和T1C-19对意大利蜜蜂幼虫及成虫的潜在毒性影响。6.3展望本研究主要是在实验室水平上从不同角度研究了两种转Bt基因抗虫水稻对意大利蜜蜂的潜在影响,得出这两种Bt水稻对意大利蜜蜂幼虫及成虫均没有影响的结论。但是,由于意大利蜜蜂的社会性属性,其生长,行为等受环境因素影响比较大,只在实验室水平上研究转基因作物对其的安全性,还不足以完全反应田间的实际情况。今后在进行包括Bt水稻在内的转基因作物风险评估时,还应开展半田间水平试验以及田间试验。另外,蜜蜂的行为学也是研究的一个重点。在研究转基因作物对蜜蜂的潜在影响时,也应该研究杀虫蛋白或转基因抗虫作物花粉对蜜蜂哺育行为、采集行为及学习行为的影响。64
中国农业科学院博士学位论文参考文献参考文献1.白耀宇,蒋明星,程家安,王敦.转Btcry1Ab基因水稻对稻田弹尾虫种群数量的影响.应用生态学报,2006,17:903-906.2.陈德龙,张莳眉,邹世颖,刘一非,周忻,贺晓云,黄昆仑.转基因耐草甘膦除草剂玉米CC-2喂养SD大鼠90天亚慢性毒性研究.农业生物技术学报,2013,21(12):1448-1457.3.陈浩.三种Bt基因(cry1Ac、cry2A和cry9C)抗虫水稻的培育及评价[博士学位论文].武汉:华中农业大学,2005.4.崔红娟.转cry1Ah基因玉米对蜜蜂中肠细菌群落和土壤微生物群落的影响[硕士学位论文].哈尔滨:东北农业大学,2011.5.崔洪志,郭三堆.Bt毒蛋白抗虫植物基因工程研究(综述).农业生物技术学报,1998,6(2):166-172.6.崔蕾,王振营,何康来,白树雄.转Btcry1Ah基因玉米花粉对龟纹瓢虫解毒酶和中肠蛋白酶活性的影响.生物安全学报,2011,(01).7.代平礼,周玮,张杰,郎志宏,周婷,王强,崔红娟,姜玮瑜,吴艳艳.转Bt-cry1Ah基因玉米花粉对意大利蜜蜂幼虫的影响.应用昆虫学报,2012,49(5).8.代平礼.转Btcry1Ah基因玉米对蜜蜂的安全性研究[博士学位论文].北京:中国农业科学院,2011.9.韩兰芝,吴孔明,彭于发,郭予元.转基因抗虫水稻生态安全性研究进展.应用与环境生物学报,2006,12(3):431-436.10.胡跃东.谈水稻粉源的利用.蜜蜂杂志,2010,30(6).11.姜玮瑜,代平礼,张永军,周婷,林毅,束长龙,张杰.转Bt-cry1Ac基因棉花对意大利蜜蜂肠道细菌群落的影响*.应用与环境生物学报,2010,(02):211-215.12.蒋晴,苏宏华,杨益众.昆虫对Bt毒素的抗性与中肠蛋白酶、解毒酶及保护酶系活性的关系.环境昆虫学报,2013,(01):95-101.13.赖友胜,刘炽松,梁正之,廖振华.利用蜜蜂为水稻辅助授粉.蜜蜂杂志,1985,(02):2-3.14.李健,官春云,李栒,陈社员.转Bt基因抗虫油菜花粉对蜜蜂生存的影响.中国油料作物学报,2003,25(2):2.15.李伟,王琛柱.棉铃虫4龄幼虫的摄食行为和中肠蛋白酶活性的变化.昆虫学报,1999:358-363.16.李兆亮,姚洪渭,陈洋,田俊策,彭于发,叶恭银.取食转Bt基因水稻褐飞虱对杀虫剂的敏感性及其代谢酶的活性.中国生物防治学报,2011,27(1):55-62.17.林良斌,官春云.Bt毒蛋白基因与植物抗虫基因工程.生物工程进展,1997,17(2):51-55.18.刘家富.蜜蜂在水稻上的访花行为及其介导花粉扩散的研究[硕士学位论文].杭州:浙江大学,2013.19.刘平.水稻主要病虫害及其防治.现代农业,2014:29-30.65
中国农业科学院博士学位论文参考文献20.刘贤进,余向阳,王冬兰,张存政,王跃.转基因棉对棉铃虫幼虫生长及中肠蛋白酶活性的影响.植物保护学报,2003,(03).21.刘艳荷,陈盛禄.转抗虫基因植物对蜜蜂的影响.昆虫知识,2001,38(4):5.22.卢宝荣,傅强,沈志成.我国转基因水稻商品化应用的潜在环境生物安全问题.生物多样性,2008,16:426-436.23.陆琼.两种Bt毒蛋白对小地老虎的毒力差异及作用机理的研究[硕士学位论文].哈尔滨:东北农业大学,2008.24.罗海峰,齐鸿雁,薛凯,张洪勋.PCR-DGGE技术在农田土壤微生物多样性研究中的应用.生态学报,2003,23(8):1570-1575.25.马悦欣,HolmstromC.,WebbJ.,KjellebergS.变性梯度凝胶电泳(DGGE)在微生物生态学中的应用.生态学报,2003,23(8):1561-1569.26.莽克强.植物基因工程进展.生物工程进展,1993:1-8.27.南春燕,马雅军,徐建农,梁健.中华按蚊幼虫肠道细菌宏基因组的组成研究.中国寄生虫学与寄生虫病杂志,2013,31(002):114-119.28.沈育初.我对意蜂不采粉的一点补充.蜜蜂杂志,2002,(10):1.29.宋怀磊.亚致死剂量溴氰菊酯和吡虫啉对意大利蜜蜂(Apismelliferaligustica)的影响.2011.30.孙宝盛,张斌,吴卿,金敏.应用PCR-DGGE技术解析MBR中微生物群落多样性.天津大学学报,2008,41(3):356-361.31.孙庆华,柏耀辉,赵翠,温东辉,唐孝炎.DGGE,T-RFLP,LH-PCR对两种活性污泥的微生物种群多样性分析的比较.环境工程学报,2009,3(8):1365-1370.32.田岩,张永军,吴孔明,赵奎军,彭于发,郭予元.转Bt-cry1Ab玉米花粉对意大利蜜蜂生长发育及体内酶活性的影响.农业生物技术学报,2006a,14(6):2.33.田岩,张永军,吴孔明,赵奎军,彭于发,郭予元.转Bt-cry1Ac棉花花粉对意大利蜜蜂生长发育的影响.应用与环境生物学报,2006b,12(4):4.34.田贞华,惠丰立,柯涛,阚云超,文桢中.家蚕肠道细菌种群结构分析.蚕业科学,2007,33(4):592-595.35.王琛柱,钦俊德.大豆胰蛋白酶抑制剂与棉酚或丹宁混用对棉铃虫中肠蛋白酶和生长率的影响.昆虫学报,1996a,(04).36.王琛柱,钦俊德.棉铃虫幼虫中肠主要蛋白酶活性的鉴定.昆虫学报,1996b,(01):7-11.37.王丽华,于凤池,姚海根.转基因水稻对蜜蜂及其产品潜在性影响研究初探.中国养蜂,2005,56(9):3.38.王丽娟,李刚,赵建宁,红雨,修伟明,王慧,章秋艳,杨殿林.耐除草剂转基因大豆对根际土壤固氮微生物nifH基因多样性的影响.中国油料作物学报,2013,35(6):703-711.39.王瀛寰,张艳峰,张旭,李建中,王会利.五种农药对中华蜜蜂和意大利蜜蜂工蜂的经口毒性比较.农药学学报,2012,(04).40.王园园,李云河,陈秀萍,武红巾,彭于发.抗虫转基因植物对非靶标节肢动物生态影响的研究进展.生物安全学报,2011,(02):100-107.41.吴杰.现代农业科技专著大系:蜜蜂学.中国农业出版社,2012:14-15.66
中国农业科学院博士学位论文参考文献42.相辉,李木旺,赵勇,赵立平,张月华,黄勇平.家蚕幼虫中肠细菌群落多样性的PCR-DGGE和16SrDNA文库序列分析.昆虫学报,2007,50(3):222-233.43.谢道听,倪丕冲.苏云金芽孢杆菌杀虫基因导入中国载培水稻品种中花11号获得转基因植.中国科学:B辑,1991:830-834.44.徐红星,郑许松,杨亚军,王新,傅强,叶恭银,吕仲贤.褐飞虱体内细菌群落的PCR-DGGE分析.中国水稻科学,2014,(2):217-222.45.徐景耀.蜜蜂办水稻授粉效果初步探讨.中国养蜂,1980,(02):24-25.46.杨虹,李家新,郭三堆,陈学军,范云六.苏云金芽孢杆菌δ-内毒素基因导入水稻原生质体后获得转基因植株.中国农业科学,1989:1-5.47.杨俊.溴氰菊酯对蜜蜂脑神经细胞内钙离子影响的研究及机理初探[硕士学位论文].北京:中国农业科学院,2012.48.余玉生,张学文,罗卫庭,陈玉香.蜜蜂采集水稻的观察研究.养蜂科技,1999,(03):33.49.张金振,赵静,吴黎明,李熠.转基因作物对蜂产品的影响及其检测方法.中国蜂业,2010,61(10).50.张兰,李建科.转基因产品对蜜蜂和熊蜂的影响.中国养蜂,2005,56(6):3.51.张巍,张志罡,付秀芹,刘立军,颜亨梅.转Bt基因水稻对稻纵卷叶螟幼虫体内三种保护酶活性的影响.昆虫学报,2008,51(10):1022-1027.52.张秀杰,刁青云,宛煜嵩,金芜军.蜂蜜中转基因成份的PCR检测.基因组学与应用生物学,2010,29(3).53.张彦,梁革梅,高珍.Vip3Aa及Cry1Ac对棉铃虫幼虫多种酶活力的影响.应用昆虫学报,2012,49(4):853-861.54.张彦.Vip3Aa毒杀棉铃虫的生理生化机制研究[硕士学位论文].北京:中国农业科学院,2012.55.张永军,孙毅,袁海滨,吴孔明,彭于发,郭予元.转Bt-cry1Ab玉米花粉对异色瓢虫生长发育及体内三种代谢酶活性的影响.2005,48:898-902.56.AlippiA.M.,LópezA.C.,AguilarO.M.DifferentiationofPaenibacilluslarvaesubsp.larvae,thecauseofAmericanfoulbroodofhoneybees,byusingPCRandrestrictionfragmentanalysisofgenesencoding16SrRNA.AppliedandEnvironmentalMicrobiology,2002,68(7):3655-3660.57.BabendreierD.,JollerD.,RomeisJ.r.,BiglerF.,WidmerF.Bacterialcommunitystructuresinhoneybeeintestinesandtheirresponsetotwoinsecticidalproteins.FEMSMicrobiologyEcology,2007,59(3):600-610.58.BabendreierD.,KalbererN.,RomeisJ.,FluriP.,BiglerF.Pollenconsumptioninhoneybeelarvae:astepforwardintheriskassessmentoftransgenicplants.Apidologie,2004,35(3):293-300.59.BabendreierD.,KalbererN.M.,RomeisJ.,FluriP.,MulliganE.,BiglerF.InfluenceofBt-transgenicpollen,Bt-toxinandproteaseinhibitor(SBTI)ingestionondevelopmentofthehypopharyngealglandsinhoneybees.Apidologie,2005,36(4):585.60.BabendreierD.,ReichhartB.,RomeisJ.,BiglerF.Impactofinsecticidalproteinsexpressedintransgenicplantsonbumblebeemicrocolonies.EntomologiaExperimentalisetApplicata,2008,126(2):148-157.67
中国农业科学院博士学位论文参考文献61.BakerH.,BakerI.Theoccurrenceandsignificanceofaminoacidsinfloralnectar.PlantSystematicsandEvolution,1986,151(3-4):175-186.62.BakerN.,WolschinF.,AmdamG.V.Age-relatedlearningdeficitscanbereversibleinhoneybeesApismellifera.ExperimentalGerontology,2012,47(10):764-772.63.BashirK.,HusnainT.,FatimaT.,RiazN.,MakhdoomR.,RiazuddinS.Novelindicabasmatiline(B-370)expressingtwounrelatedgenesofBacillusthuringiensisishighlyresistanttotwolepidopteraninsectsinthefield.CropProtection,2005,24(10):870-879.64.BoschJ.,KempW.P.,TrostleG.E.BeepopulationreturnsandcherryyieldsinanorchardpollinatedwithOsmialignaria(Hymenoptera:Megachilidae).Journalofeconomicentomology,2006,99(2):408-413.65.BoschJ.,VicensN.SexallocationinthesolitarybeeOsmiacornuta:dofemalesbehaveinagreementwithFisher"stheory?BehavioralEcologyandSociobiology,2005,59(1):124-132.66.BourtzisK.,HendriksmaH.P.,KütingM.,HärtelS.,NätherA.,DohrmannA.B.,Steffan-DewenterI.,TebbeC.C.EffectofstackedinsecticidalCryproteinsfrommaizepollenonnursebees(Apismelliferacarnica)andtheirgutbacteria.PLoSONE,2013,8(3):e59589.67.BrødsgaardH.F.,BrødsgaardC.J.,HenrikandH.,GáborL.Lövei.Environmentalriskassessmentoftransgenicplantsusinghoneybeelarvae.DocumentTransformationTechnologies,2001.68.BrødsgaardH.F.,BrødsgaardC.J.,HenrikandH.,GáborL.Lövei.Environmentalriskassessmentoftransgeneproductsusinghoneybee(Apismellifera)larvaeApidologie,2003,34(2):139-145.69.BurgessE.P.,MaloneL.A.,ChristellerJ.T.Effectsoftwoproteinaseinhibitorsonthedigestiveenzymesandsurvivalofhoneybees(Apismellifera).JournalofInsectPhysiology,1996,42(9):823-828.70.ChenH.,TangW.,XuC.,LiX.,LinY.,ZhangQ.Transgenicindicariceplantsharboringasyntheticcry2A*geneofBacillusthuringiensisexhibitenhancedresistanceagainstlepidopteranricepests.TheoreticalandAppliedGenetics,2005,111(7):1330-1337.71.ChenH.,ZhangG.,ZhangQ.,LinY.EffectoftransgenicBacillusthuringiensisricelinesonmortalityandfeedingbehaviorofricestemborers(Lepidoptera:Crambidae).Journalofeconomicentomology,2008,101(1):182-189.72.ChenM.,SheltonA.,YeG.Y.Insect-resistantgeneticallymodifiedriceinChina:fromresearchtocommercialization.AnnualReviewofEntomology,2011,56:81-101.73.ChengX.,SardanaR.,KaplanH.,AltosaarI.Agrobacterium-transformedriceplantsexpressingsyntheticcryIA(b)andcryIA(c)genesarehighlytoxictostripedstemborerandyellowstemborer.ProcNatlAcadSciUSA,1998.74.CohenM.B.,ArpaiaS.,LanL.P.,ChauL.M.,SnowA.A.Sharedfloweringphenology,insectpests,andpathogensamongwild,weedy,andcultivatedriceintheMekongDelta,Vietnam:implicationsfortransgenicrice.EnvironmentalBiosafetyResearch,2008,7(2):73-85.75.Cox-FosterD.L.,ConlanS.,HolmesE.C.,PalaciosG.,EvansJ.D.,MoranN.A.,QuanP.-L.,BrieseT.,HornigM.,GeiserD.M.Ametagenomicsurveyofmicrobesinhoneybeecolonycollapsedisorder.68
中国农业科学院博士学位论文参考文献Science,2007,318(5848):283-287.76.CrailsheimK.Theproteinbalanceofthehoneybeeworker.Apidologie,1990,21(5):417-429.77.DaiP.L.,ZhouW.,ZhangJ.,CuiH.J.,WangQ.,JiangW.Y.,SunJ.H.,WuY.Y.,ZhouT.FieldassessmentofBtcry1Ahcornpollenonthesurvival,developmentandbehaviorofApismelliferaligustica.EcotoxicologyandEnvironmentalSafety,2012b,79:232-237.78.DaiP.L.,ZhouW.,ZhangJ.,JiangW.Y.,WangQ.,CuiH.J.,SunJ.H.,WuY.Y.,ZhouT.TheeffectsofBtCry1Ahtoxinonworkerhoneybees(ApismelliferaligusticaandApisceranacerana).Apidologie,2012a,43(4):384-391.79.DecourtyeA.,LeMetayerM.,PottiauH.,TisseurM.,OdouxJ.,Pham-DelegueM.,BelzuncesL.,PelissierC.,LewisG.Impairmentofolfactorylearningperformancesinthehoneybeeafterlongtermingestionofimidacloprid.COLLOQUES-INRA,2001:113-120.80.DillonR.,DillonV.Thegutbacteriaofinsects:nonpathogenicinteractions.AnnualReviewsinEntomology,2004,49(1):71-92.81.DisayathanoowatT.,YoungJ.P.,HelgasonT.,ChantawannakulP.T-RFLPanalysisofbacterialcommunitiesinthemidgutsofApismelliferaandApisceranahoneybeesinThailand.FEMSMicrobiolEcol,2012,79(2):273-281.82.DuanJ.J.,MarvierM.,HuesingJ.,DivelyG.,HuangZ.Y.Ameta-analysisofeffectsofBtcropsonhoneybees(Hymenoptera:Apidae).PLoSONE,2008,3(1):e1415.83.DuanX.,LiX.,XueQ.,AboM.TransgenicriceplantsharboringanintroducedpotatoproteinaseinhibitorIIgeneareinsectresistant.NatBiotechnol,1996,14(4):494-498.84.Garcia-AlonsoM.,JacobsE.,RaybouldA.,NicksonT.E.,SowigP.,WillekensH.,VanDerKouweP.,LaytonR.,AmijeeF.,FuentesA.M.,TencallaF.Atieredsystemforassessingtheriskofgeneticallymodifiedplantstonon-targetorganisms.EnvironmentalBiosafetyResearch,2006,5(2):57-65.85.GengL.L.,CuiH.J.,DaiP.L.,LangZ.H.,ShuC.L.,ZhouT.,SongF.P.,ZhangJ.TheinfluenceofBt-transgenicmaizepollenonthebacterialdiversityinthemidgutofApismelliferaligustica.Apidologie,2013,44(2):198-208.86.GhareyazieB.,AliniaF.,MenguitoC.A.,RubiaL.G.,dePalmaJ.M.,LiwanagE.A.,CohenM.B.,KhushG.S.,BennettJ.EnhancedresistancetotwostemborersinanaromaticricecontainingasyntheticcryIA(b)gene.MolecularBreeding,1997,volume3(5):401-414(414).87.GrallienE.,MarilleauR.,Pham-DelègueM.,Picard-NizouA.,JouaninL.,Marion-PollF.Impactofpestinsectresistantoilseedrapeonhoneybees.Rapeseedtodayandtomorow,9thInternationalrapeseedcongress,Cambridge,UK,1995.88.GunningR.NewresistancemechanisminHelicoverpaarmigerathreatenstransgeniccropsexpressingBacillusthuringiensiscry1Actoxin.AppliedandEnvironmentalMicrobiology,2005,71(5):2558-2563.89.HanP.,NiuC.Y.,BiondiA.,DesneuxN.DoestransgenicCry1Ac+CpTIcottonpollenaffecthypopharyngealglanddevelopmentandmidgutproteolyticenzymeactivityinthehoneybeeApis69
中国农业科学院博士学位论文参考文献melliferaL.(Hymenoptera,Apidae)?Ecotoxicology,2012,21(8):2214-2221.90.HanP.,NiuC.Y.,LeiC.L.,CuiJ.J.,DesneuxN.QuantificationoftoxinsinaCry1Ac+CpTIcottoncultivaranditspotentialeffectsonthehoneybeeApismelliferaL.Ecotoxicology,2010a,19(8):1452-1459.91.HanP.,NiuC.Y.,LeiC.L.,CuiJ.J.,DesneuxN.UseofaninnovativeT-tubemazeassayandtheproboscisextensionresponseassaytoassesssublethaleffectsofGMproductsandpesticidesonlearningcapacityofthehoneybeeApismelliferaL.Ecotoxicology,2010b,19(8):1612-1619.92.HectorA.,DuanJ.J.,MarvierM.,HuesingJ.,DivelyG.,HuangZ.Y.Ameta-analysisofeffectsofBtcropsonhoneybees(Hymenoptera:Apidae).PLoSONE,2008,3(1):e1415.93.HendriksmaH.P.Testingpollenofsingleandstackedinsect-resistantBt-maizeoninvitrorearedhoneybeelarvae.PLoSONE,2011b,6(12)(12).94.HendriksmaH.P.,HärtelS.,BabendreierD.,vonderOheW.,Steffan-DewenterI.EffectsofmultipleBtproteinsandGNAlectinoninvitro-rearedhoneybeelarvae.Apidologie,2012,43(5):549-560.95.HendriksmaH.P.,HärtelS.,Steffan-DewenterI.Honeybeeriskassessment:newapproachesforinvitrolarvaerearinganddataanalyses.MethodsinEcologyandEvolution,2011a,2(5):509-517.96.HendriksmaH.P.,KütingM.,HärtelS.,NätherA.,DohrmannA.B.,Steffan-DewenterI.,TebbeC.C.EffectofstackedinsecticidalCryproteinsfrommaizepollenonnursebees(Apismelliferacarnica)andtheirgutbacteria.PLoSONE,2013,8(3):e59589.97.HenryM.,BeguinM.,RequierF.,RollinO.,OdouxJ.F.,AupinelP.,AptelJ.,TchamitchianS.,DecourtyeA.Acommonpesticidedecreasesforagingsuccessandsurvivalinhoneybees.Science,2012,336(6079):348-350.98.JamesC.Globalstatusofcommercializedbiotech/GMCrops:2014.ISAAABriefNO.49,2014.99.JiangW.Y.,GengL.L.,DaiP.L.,LangZ.H.,ShuC.L.,LinY.,ZhouT.,SongF.P.,ZhangJ.TheinfluenceofBt-transgenicmaizepollenonthebacterialdiversityinthemidgutofChinesehoneybees,Apisceranacerana.JournalofIntegrativeAgriculture,2013,12(3):474-482.100.KonradR.Potentialeffectsofinsect-resistanttransgenicplantsonsolitarybees[PhD].2008.101.KonradR.,FerryN.,GatehouseA.M.R.,BabendreierD.PotentialeffectsofoilseedrapeexpressingOryzacystatin-1(OC-1)andofpurifiedinsecticidalproteinsonlarvaeoftheSolitarybeeOsmiabicornis.PLoSONE,2008,3(7):e2664.102.LehrmanA.Doespealectinexpressedtransgenicallyinoilseedrape(Brassicanapus)influencehoneybee(Apismellifera)larvae?EnvironmentalBiosafetyResearch,2007,6(4):271-278.103.LiY.,HuL.,RomeisJ.,WangY.,HanL.,ChenX.,PengY.Useofanartificialdietsystemtostudythetoxicityofgut-activeinsecticidalcompoundsonlarvaeofthegreenlacewingChrysoperlasinica.BiologicalControl,2014,69:45-51.104.LiY.,MeissleM.,andRomeisJ.ConsumptionofBtmaizepollenexpressingCry1AborCry3Bb1doesnotharmadultgreenlacewings,Chrysoperlacarnea(Neuroptera:Chrysopidae).PLoSOne,2008:3:e2909.DOI:2910.1371/journal.pone.0002909105.LiY.,WangY.,RomeisJ.,LiuQ.,LinK.,ChenX.,PengY.BtriceexpressingCry2Aadoesnot70
中国农业科学院博士学位论文参考文献causedirectdetrimentaleffectsonlarvaeofChrysoperlasinica.Ecotoxicology,2013b,22(9):1413-1421.106.LiY.,ZhangX.,ChenX.,RomeisJ.,YinX.,PengY.ConsumptionofBtricepollencontainingCry1CorCry2AdoesnotposearisktoPropyleajaponica(Thunberg)(Coleoptera:Coccinellidae).SciRep,2015,5:7679.107.LiY.H.,RomeisJ.,WuK.M.,PengY.F.Tier-1assaysforassessingthetoxicityofinsecticidalproteinsproducedbygeneticallyengineeredplantstonon-targetarthropods.InsectScience,2013c.108.LiY.H.,RomeisJ.,WuK.M.,PengY.F.Tier-1assaysforassessingthetoxicityofinsecticidalproteinsproducedbygeneticallyengineeredplantstonon-targetarthropods.InsectScience,2013a,21(2):125-134.109.LiYunheandRomeisJ.BtmaizeexpressingCry3Bb1doesnotharmthespidermite,Tetranychusurticae,oritsladybirdbeetlepredator,Stethoruspunctillum.BiologicalControl,2010,53(3):337-344.110.LiYunheandRomeisJ.Impactofsnowdroplectin(Galanthusnivalisagglutinin;GNA)onadultsofthegreenlacewing,Chrysoperlacarnea.JournalofInsectPhysiology,2009,55(2):136-143.111.LimaM.A.P.,PiresC.S.S.,GuedesR.N.C.,NakasuE.Y.T.,LaraM.S.,FontesE.M.G.,SujiiE.R.,DiasS.C.,CamposL.A.O.DoesCry1AcBt-toxinimpairdevelopmentofworkerlarvaeofAfricanizedhoneybee?JournalofAppliedEntomology,2011,135(6):415-422.112.LiuB.,ShuC.,XueK.,ZhouK.,LiX.,LiuD.,ZhengY.,XuC.TheoraltoxicityofthetransgenicBt+CpTIcottonpollentohoneybees(Apismellifera).EcotoxicolEnvironSaf,2009,72(4):1163-1169.113.LiuB.,XuC.,YanF.,GongR.Theimpactsofthepollenofinsect-resistanttransgeniccottononhoneybees.BiodiversityandConservation,2005,14(14):3487-3496.114.MaloneL.Literaturereviewongeneticallymodifiedplantsandbeeproducts.HortResearchClientReport,2002.115.MaloneL.,BurgessE.Impactofgeneticallymodifiedcropsonpollinators.EnvironmentalImpactofGeneticallyModifiedCrops,CABInternational,2009:199-222.116.MaloneL.,Burgess,E.P.J.,Gatehouse,H.S.,VoiseyC.R.,TregidgaE.L.,PhilipB.A.EffectsofingestionofaBacillusthuringiensistoxinandatrypsininhibitoronhoneybeeflightactivityandlongevity.Apidologie,2001,32:57-68.117.MaloneL.A.,BurgessE.P.,ChristellerJ.T.,GatehouseH.S.Invivoresponsesofhoneybeemidgutproteasestotwoproteaseinhibitorsfrompotato.JournalofInsectPhysiology,1998,44(2):141-147.118.MaloneL.A.,BurgessE.P.J.,StefanovicD.EffectsofaBacillusthuringiensistoxin,twoBacillusthuringiensisbio-pesticideformulationsandasoybeantrypsininhibitoronhoneybee(ApismelliferaL.)survivalandfoodconsumption.Apidologie,1999,30:465-473.119.MaloneL.A.,BurgessE.P.J.,StefanovicD.,GatehouseH.S.Effectsoffourproteaseinhibitorsonthesurvivalofworkerbumblebees,BombusterrestrisL.Apidologie,2000,31(1):25-38.120.MaloneL.A.,GatehouseA.M.R.,BarrattB.I.P,Ed.BeyondBt:Alter-nativestrategiesforinsect-71
中国农业科学院博士学位论文参考文献resistantgeneticallymodifiedcrops.IntergationofInsect-ResistantGeneticallyModifiedCropsWithIPMPrograms.Berlin,Springer,2008.121.MaloneL.A.,GiaconH.A.,BurgessE.P.,MaxwellJ.Z.,ChristellerJ.T.,LaingW.A.Toxicityoftrypsinendopeptidaseinhibitorstohoneybees(Hymenoptera:Apidae).Journalofeconomicentomology,1995,88(1):46-50.122.MaloneL.A.,Pham-DeleguepM.H.Effectsoftransgeneproductsonhoneybees(Apismellifera)andbumblebees(Bombussp.).Apidologie,2001,32:1-18.123.MaloneL.A.,ToddJ.H.,BurgessE.P.J.,ChristellerJ.T.DevelopmentofhypopharyngealglandsinadulthoneybeesfedwithaBttoxin,abiotin-bindingproteinandaproteaseinhibitor.Apidologie,2004,35(6):655-664.124.MaloneL.A.,ToddJ.H.,BurgessE.P.J.,WalterC.,WagnerA.,BarrattB.I.P.Developingriskhypothesesandselectingspeciesforassessingnon-targetimpactsofGMtreeswithnoveltraits:Thecaseofaltered-ligninpinetrees.EnvironmentalBiosafetyResearch,2011,9(4):181-198.125.MaqboolS.B.,ChristouP.Multipletraitsofagronomicimportanceintransgenicindicariceplants:analysisoftransgeneintegrationpatterns,expressionlevelsandstability.MolecularBreeding,1999,volume5(5):471-480(410).126.MartinsonV.G.,MoyJ.,MoranN.A.Establishmentofcharacteristicgutbacteriaduringdevelopmentofthehoneybeeworker.ApplEnvironMicrobiol,2012,78(8):2830-2840.127.MohrK.I.,TebbeC.C.Diversityandphylotypeconsistencyofbacteriainthegutsofthreebeespecies(Apoidea)atanoilseedrapefield.EnvironmentalMicrobiology,2006,8(2):258-272.128.MommaertsV.,JansK.,SmaggheG.ImpactofBacillusthuringiensisstrainsonsurvival,reproductionandforagingbehaviourinbumblebees(Bombusterrestris).PestManagementScience,2010,66(5):520-525.129.MoranN.A.,HansenA.K.,PowellJ.E.,SabreeZ.L.Distinctivegutmicrobiotaofhoneybeesassessedusingdeepsamplingfromindividualworkerbees.PLoSONE,2012,7(4):e36393.130.NakatsuC.H.,TorsvikV.,ØvreåsL.SoilcommunityanalysisusingDGGEof16SrDNApolymerasechainreactionproducts.SoilScienceSocietyofAmericaJournal,2000,64(4):1382-1388.131.NayakP.,BasuD.,DasS.,BasuA.,GhoshD.,RamakrishnanN.A.,GhoshM.,SenS.K.TransgeniceliteindicariceplantsexpressingCryIAcdelta-endotoxinofBacillusthuringiensisareresistantagainstyellowstemborer(Scirpophagaincertulas).ProcNatlAcadSciUSA,1997.132.NiuL.,MaY.,MannakkaraA.,ZhaoY.,MaW.,LeiC.,ChenL.Impactofsingleandstackedinsect-resistantBt-cottononthehoneybeeandsilkworm.PLoSONE,2013,8(9):e72988.133.OppertB.,KramerK.J.,JohnsonD.,UptonS.J.,McGaugheyW.H.LuminalproteinasesfromPlodiainterpunctellaandthehydrolysisofBacillusthuringiensisCryIA(c)protoxin.InsectBiochemistryandMolecularBiology,1996,26(6):571–583.134.PatelN.,HaydakM.,GochnauerT.Electrophoreticcomponentsoftheproteinsinhoneybeelarvalfood.Nature,1960,186(4725):633-634.135.Ramirez-RomeroR.,DesneuxN.,DecourtyeA.,ChaffiolA.,Pham-DelègueM.H.DoesCry1Ab72
中国农业科学院博士学位论文参考文献proteinaffectlearningperformancesofthehoneybeeApismelliferaL.(Hymenoptera,Apidae)?EcotoxicologyandEnvironmentalSafety,2008,70(2):327-333.136.RomeisJ.,BartschD.,BiglerF.,CandolfiM.P.,GielkensM.M.C.,HartleyS.E.,HellmichR.L.,HuesingJ.E.,JepsonP.C.,LaytonR.,QuemadaH.,RaybouldA.,RoseR.I.,SchiemannJ.,SearsM.K.,SheltonA.M.,SweetJ.,VaituzisZ.,WoltJ.D.Assessmentofriskofinsect-resistanttransgeniccropstonontargetarthropods.NatureBiotechnology,2008a,26(2):203-208.137.RomeisJ.,DuttonA.,BiglerF.Bacillusthuringiensistoxin(Cry1Ab)hasnodirecteffectonlarvaeofthegreenlacewingChrysoperlacarnea(Stephens)(Neuroptera:Chrysopidae).JournalofInsectPhysiology,2004,50(2-3):175-183.138.RomeisJ.,McLeanM.A.Improvingdesignqualityofearly-tiernon-targetarthropodstudies.ISBNewsReport,2011:6-8.139.RomeisJ.,MeissleM.,BiglerF.TransgeniccropsexpressingBacillusthuringiensistoxinsandbiologicalcontrol.NatureBiotechnology,2006,24(1):63-71.140.RomeisJ.,RaybouldA.,BiglerF.,CandolfiM.P.,HellmichR.L.,HuesingJ.E.,SheltonA.M.Derivingcriteriatoselectarthropodspeciesforlaboratoryteststoassesstheecologicalrisksfromcultivatingarthropod-resistantgeneticallyengineeredcrops.Chemosphere,2013,90(3):901-909.141.RomeisJ.,VanDriescheR.G.,BarrattB.I.,BiglerF.Insect-resistanttransgeniccropsandbiologicalcontrol.IntegrationofInsect-ResistantGeneticallyModifiedCropswithinIPMPrograms,Springer,2008b:87-117.142.RoseR.,DivelyG.P.,PettisJ.EffectsofBtcornpollenonhoneybees:emphasisonprotocoldevelopment.Apidologie,2007,38(4):368-377.143.SabreeZ.L.,HansenA.K.,MoranN.A.Independentstudiesusingdeepsequencingresolvethesamesetofcorebacterialspeciesdominatinggutcommunitiesofhoneybees.PLoSONE,2012,7(7):e41250.144.SagiliR.R.,PankiwT.,Zhu-SalzmanK.Effectsofsoybeantrypsininhibitoronhypopharyngealglandproteincontent,totalmidgutproteaseactivityandsurvivalofthehoneybee(ApismelliferaL.).JournalofInsectPhysiology,2005,51(9):953-957.145.SilvaI.C.,MessageD.,CruzC.D.,CamposL.A.,Sousa-MajerM.J.RearingAfricanizedhoneybee(ApismelliferaL.)broodunderlaboratoryconditions.Geneticsandmolecularresearch,2009,8(2):623-629.146.StokstadE.Fieldresearchonbeesraisesconcernaboutlow-dosepesticides.Science,2012,335(6076):1555.147.TangW.,ChenH.,XuC.,LiX.,LinY.,ZhangQ.Developmentofinsect-resistanttransgenicindicaricewithasyntheticcry1C*gene.MolecularBreeding,2006,18(1):1-10.148.UnitedStatesEnvironmentalProtectionAgency[USEPA].Whitepaperontier-basedtestingfortheeffectsofproteinaceousinsecticidalplant-incorporatedprotectantsonnon-targetarthropodsforregulatoryriskassessment.Washington,DC:U.S.EnvironmentalProtectionAgency,2007.149.VainP.,WorlandB.,ClarkeM.C.,RichardG.,BeavisM.,LiuH.,KohliA.,LeechM.,SnapeJ.,73
中国农业科学院博士学位论文参考文献ChristouP.Expressionofanengineeredcysteineproteinaseinhibitor(Oryzacystatin-IΔD86)fornematoderesistanceintransgenicriceplants.TheoreticalandAppliedGenetics,1998,96(2):266-271.150.vanderSteenJ.J.Reviewofthemethodstodeterminethehazardandtoxicityofpesticidestobumblebees.Apidologie,2001,32(5):399-406.151.VojvodicS.,RehanS.M.,AndersonK.E.MicrobialgutdiversityofAfricanizedandEuropeanhoneybeelarvalinstars.PLoSONE,2013,8(8):e72106.152.WangY.,LiY.,RomeisJ.,ChenX.,ZhangJ.,ChenH.,PengY.ConsumptionofBtricepollenexpressingCry2AadoesnotcauseadverseeffectsonadultChrysoperlasinicaTjeder(Neuroptera:Chrysopidae).BiologicalControl,2012,61(3):246-251.153.WhitehornP.R.,O’ConnorS.,WackersF.L.,GoulsonD.Neonicotinoidpesticidereducesbumblebeecolonygrowthandqueenproduction.Science,2012,336(6079):351-352.154.WolfenbargerL.L.,PhiferP.R.Theecologicalrisksandbenefitsofgeneticallyengineeredplants.Science,2000,290(5499):2088-2093.155.WünnJ.,KlötiA.,BurkhardtP.K.,BiswasG.C.,LaunisK.,IglesiasV.A.,PotrykusI.TransgenicIndicaricebreedinglineIR58expressingasyntheticcryIA(b)genefromBacillusthuringiensisprovideseffectiveinsectpestcontrol.Bio/Technolgy,1996,(2).156.YangY.IntrogressionofadisruptedcadheringeneenablessusceptibleHelicoverpaarmigeratoobtainresistancetoBacillusthuringiensistoxinCry1Ac.BulletinofEntomologicalResearch,2009,99(2):175-181.157.ZhangX.,LiY.,RomeisJ.,YinX.,WuK.,PengY.Useofapollen-baseddiettoexposetheladybirdbeetlePropyleajaponicatoInsecticidalProteins.PLoSONE,2014,9(1):e85395.158.ZhangY.,LiY.,ZhangY.,ChenY.,WuK.,PengY.,GuoY.SeasonalExpressionofBtproteinsintransgenicricelinesandtheresistanceagainstasiaticriceborerChilosuppressalis(Walker).EnvironmentalEntomology,2011,40(5):1323-1330.159.ZindelR.,OfekM.,MinzD.,PalevskyE.,Zchori-FeinE.,AebiA.TheroleofthebacterialcommunityinthenutritionalecologyofthebulbmiteRhizoglyphusrobini(Acari:Astigmata:Acaridae).FASEBJ,2013,27(4):1488-1497.74
中国农业科学院博士学位论文参考文献致谢在论文即将梓刻之际,回忆三年博士生涯,感受颇多。有过成功的喜悦,亦有过失败的沮丧,有太多的人和事值得记忆。首先感谢我的导师彭于发研究员给了我继续深造的机会。自成为彭老师的学生起,六年来聆听彭老师教诲,耳濡目染,在学识和做人方面都获益颇丰。彭老师是我前行中的引路人,是我精神上的坚强后盾,同时也是改变我命运的贵人。师母武红巾老师温婉而大气,幽默风趣,在生活上给予了我太多的帮助,让我真切感受到家人般的温暖。在此,向恩师和师母致以崇高的敬意和深深的感谢!其次感谢李云河老师细心指导我的学习与研究。李老师专业基础扎实,对所研究领域有独到的见解。从硕士阶段起,李老师就开始指导我的研究内容,对我严格要求。从开题到中期再到实验完成整个过程中,全程指导,并提供了大量的参考资料,帮助我提高试验技能,能够及时发现、分析并解决问题,避免我走弯路,使我顺利完成研究内容。平时敦促我练习写作,在文章发表和论文撰写时,花费了大量时间和精力修改。然后要特别感谢中国农科院蜜蜂所代平礼老师和美国密歇根大学黄智勇教授对我试验的帮助。代老师不厌其烦地给我讲解蜜蜂饲养、试验的相关知识,使我能够在短时间内迅速掌握知识并顺利开展实验。同时,不辞辛苦,几次亲自将我实验所用的意大利蜜蜂从香山运送至植保所廊坊中试基地,并提供养蜂及实验所需的工具及材料。黄智勇教授更是不远万里从美国来到廊坊基地亲自指导试验并传授实验技能。还要感谢本研究室的谢家建老师、陈秀萍老师、韩兰芝老师在实验上的帮助和生活上的关心。感谢苏长青师姐和汪巧师姐三年来对我的关心和照顾,两位师姐虽然已经毕业多年,但是经常问询我的近况,在我情绪低落时能及时给以帮助。感谢王亚南、王兴云、刘清松、杨艳、朱昊俊、刘艳敏、陈怡在生活和学习上提供帮助,还有感谢其它小师弟师妹带来的欢乐。感谢、李艳玲姐姐、李淑红姐姐在实验过程中付出了艰苦的劳动,感谢已经离开我们实验室的胡龙,在养蜂过程和实验中给了我巨大的帮助,使我的实验能顺利完成,在此致以诚挚的谢意。感谢我的室友王增霞、唐秀丽、陈方陪我度过三年博士生活,给了我家人般的温暖。感谢的我好朋友曹伟、江丽娟、赵梅婷、徐秀秀、张凌娇、姜腾飞、石保坤、王松莹这些年对我的关心和帮助。感谢我的家人对我的理解、鼓励和支持,使我安心学习,不断进步。最后在论文即将完成之际,再次感谢所有帮助过我的老师、同学、朋友和家人。王园园2015年5月于北京75
中国农业科学院博士学位论文参考文献个人简历基本情况姓名:王园园性别:女出生年月:1984.04籍贯:山东济宁民族:汉政治面貌:群众教育背景博士研究生教育2012.09-2015.07中国业科学院植物保护研究所生物安全专业农学博士学位研究方向:转基因生物安全导师:彭于发研究员论文题目:转cry2A和cry1C基因水稻对意大利蜜蜂的生态安全性硕士研究生教育2009.09-2012.07中国业科学院植物保护研究所生物安全专业农学硕士学位研究方向:转基因生物安全导师:彭于发研究员论文题目:转Bt基因水稻Cry蛋白的表达及其对中华通草蛉的潜在影响本科教育2005.09-2009.07青岛农业大学植物保护学院植物保护专业农学学士学位实习指导老师:赵洪海教授论文题目:杜鹃花上植物寄生线虫的鉴定参与科研项目:1.植物病虫害生物学国家重点实验室课题《转cry2A基因水稻对中华草蛉的环境安全评价》(SKL2010SR06)2.转基因生物新品种培育重大专项课题《转基因水稻环境安全评价技术》(2011ZX08011-001)3.转基因新品种培育重大专项(2013ZX08011-001/2014ZX08011-001)76
中国农业科学院博士学位论文参考文献实验技能1.能够独立设计并完成试验,熟练掌握生物学测定试验技能,并进行数据分析。2.能够熟练操作酶活测定、ELISA、组织切片、电泳、PCR-DGGE等试验技术,了解SDS-PAGE,WesternBlotting操作步骤。3.熟练操作实验所需的各种仪器,如真空冷冻干燥仪、酶标仪、电泳仪、PCR仪、凝胶成像分析系统等。外语及计算机水平:英语:2008年6月通过CET-6,总分501分;具备良好的听说读写能力,能够熟练阅读并撰写英文文章计算机:熟练使用Endnote、Mega5.0等专业应用软件,精通Office办公软件个人成果发表文章:(五年内影响因子)1.王园园,李云河,陈秀萍,武红巾,彭于发(2011)抗虫转基因植物对非靶标节肢动物生态影响的研究进展.生物安全学报:100-107.2.WangYY,LiYH,RomeisJ,ChenXP,ZhangJ,ChenHY,PengYF.(2012)ConsumptionofBtricepollenexpressingCry2AadoesnotcauseadverseeffectsonadultChrysoperlasinicaTjeder(Neuroptera:Chrysopidae).BiologicalControl61:246-251.(IF=2.244)3.LiYH1,WangYY1,RomeisJ,LiuQS,LinKJ,ChenXP,PengYF.(2013)BtriceexpressingCry2AadoesnotcausedirectdetrimentaleffectsonlarvaeofChrysoperlasinica.Ecotoxicology22:1413-1421.(IF=3.19,并列一作)4.WangYY,LiYH,HuangZY,RomeisJ,DaiPL,GengLL,PengYF.(2015)AcomprehensiveanalysisrevealsnodetrimentaleffectofCry1CandCry2Aonlarvaeofthehoneybee,Apismellifera.JournalofAgricultureandFoodChemistry(reviewed).(IF=3.387)待发文章:1.WangYY,LiYH,PengYF.Effectsoftransgeniccry1corcry2ApollenandCryproteinsontheadultofhoneybeeApismellifera.2.WangYY,LiYH,PengYF.TheinfluenceoftwoCryproteinsonthebacterialdiversityinthemidgutofApismellifera.3.WangYY,LiYH,PengYF.TransgenicricelineexpressingCry1CorCry2Aproteinsdidnotharmtothedevelopmentoflarvaeofhoneybee,Apismellifera.4.王园园,李云河,彭于发.转基因抗虫作物对传粉蜂类影响的研究进展.申请专利:1.李云河,王园园,彭于发.胃毒性杀虫剂或转基因杀虫蛋白对意大利蜜蜂幼虫潜在毒性的检测方法.申请号:201410450031.777
您可能关注的文档
- 意大利蜜蜂与中华蜜蜂工蜂咽下腺基因表达分析
- 意大利蜜蜂工蜂幼虫和成蜂饲粮中亚油酸适宜添加水平的研究
- 蜂蜜浓缩生产实用工艺规程
- 天麻萌发菌、蜜环菌培养技术规程
- 油菜蜂蜜成熟过程中蛋白质和糖分变化的研究
- 海南省菠萝蜜三种重要病害病原鉴定、生物学特性研究及室内药剂筛选
- 糖蜜乙醇废液页岩砖抗剪性能研究
- 营养和空间因素对蜜蜂级型分化的影响
- 野生蜜环菌属jz-10菌和齿菌属wj-1菌遗传学鉴定及jz-10菌初步育种研究
- 预测温州蜜柑果实贮藏寿命生物标记的开发
- 杀虫剂对中华蜜蜂解毒酶的影响
- 浓缩糖蜜发酵液对奶牛瘤胃发酵和生产性能的影响
- 用主蛋白-1特异性多抗检测蜂王浆新鲜度和掺假蜂蜜的elisa技术研究
- 蜜蜂因子疗法------回归自然、弘扬中华传统医学的典型特色医疗
- 蜂蜜和蜂王浆中多种杀螨剂残留检测方法研究
- 蜂蜜对急性酒精中毒大鼠胃黏膜损伤的保护作用及其机制的初步研究
- 蜜炙黄芪化学成分分析及作用于脾气虚大鼠的药效学评价