- 720.48 KB
- 2022-06-16 12:29:21 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
自然杂志第34卷第6期诺贝尔奖简介doi:10.3969/j.issn.0253-9608.2012.06.005G蛋白偶联受体:七次跨膜结构的超级分子———2012年诺贝尔化学奖简介路伟振①吴蓓丽②赵强③①硕士,②③研究员,中国科学院上海药物研究所,中国科学院受体结构与功能重点实验室,上海201203关键词G蛋白偶联受体肾上腺素受体七次跨膜结构G蛋白偶联受体是人类基因组中最大也是最重要的一类蛋白质,它们几乎参与了生物体中所有的生命活动。这一类受体的发现、功能研究以及结构解析为我们了解生理调控以及疾病的发生与治疗等带来新的曙光。在此之前,G蛋白偶联受体的相关研究已经被九次授予诺贝尔奖,而2012年,诺贝尔化学奖再次授予RobertJ.Lefkowitz和BrianK.Kobilka,以表彰他们在此领域,尤其是肾上腺素受体上的相关研究。文中简介了G蛋白偶联受体的研究历程,其独特的七次跨膜结构与激活机制,并对此领域的未来发展做了展望。G蛋白偶联受体(G-proteincoupledreceptor,一殊荣不仅将G蛋白偶联受体的研究带到了一个新的GPCR)也称为七次跨膜受体,是一类膜受体超家族,目高度,也必然引起新一轮的G蛋白偶联受体研究热潮。前约有800多个成员,人类基因组中有超过2%的基因用来编码G蛋白偶联受体。G蛋白偶联受体是细胞表面参与信号传导的分子中数目最庞大的家族,它们可以1G蛋白偶联受体的发现与研究历程感应无数种不同的细胞外信号,并进一步诱发相应的细G蛋白偶联受体的发现已经有很长的历史,可以追胞反应。正是由于感光、感应化学分子的G蛋白偶联受溯到19世纪中期。1870年研究人员发现了光敏感的视体的存在,才形成了我们的视觉、嗅觉和味觉等一系列紫质(rhodopsin),在此基础上,GeorgeWald在1933年的感知;而感应荷尔蒙的G蛋白偶联受体更是参与了机又发现了视紫红质,其后的几十年间围绕视紫红质开展体内很多重要的生理过程,例如神经递质传递、腺体中了大量的工作,对其作用机制进行了深入的研究,并成激素和酶的释放、免疫反应、心肌和平滑肌的收缩以及为G蛋白偶联受体研究的最重要的研究模型系统之一。血压的调控等等。由于这些受体功能的多样性与重要但是在当时,并没有人把感光系统与体内激素的生理作性,几乎所有的人类疾病中都可以发现G蛋白偶联受体用联系起来。虽然受体理论在此之前就已经创立,并在的影子,这些受体功能的紊乱与调控的异常会导致相应随后得到迅速的发展,但是关于受体本身是什么物质仍疾病的发生,因此这一受体超家族一直被视为最好的药然是充满了疑问与争论,甚至有人质疑受体是否真的物靶点。事实上,已经证实现今药物制剂作用的靶点中存在。超过50%都是G蛋白偶联受体[1]。1968年,RobertJ.Lefkowitz开始利用放射性同位迄今为止,β2肾上腺素受体(β2AR)的相关研究就素追踪细胞表面受体,β2肾上腺素受体的发现就得益已经两次获得诺贝尔奖。在1988年,JamesBlack就由于这种方法。首先他通过放射性同位素标记,证明细于在肾上腺素受体阻断剂心得安(propranolol)方面的胞表面存在特异识别肾上腺素的物质,接着他与他的研究获得诺贝尔生理学或医学奖,而2012年的诺贝尔研究小组发现利用去污剂可以增加这种特异性物质的化学奖授予美国的两名科学家RobertJ.Lefkowitz和可溶性,并使用肾上腺素将其受体从细胞膜中抽离了BrianK.Kobilka,以表彰他们在G蛋白偶联受体研究出来。随后,BrianK.Kobilka加入了RobertJ.中作出的突出贡献,特别是对β2肾上腺素受体进行了Lefkowitz的研究团队,开创性地将β2肾上腺素受体高分辨率的结构解析和深入的功能研究,为揭示G蛋白的编码基因从仓鼠基因组中分离出来。通过序列比偶联受体的作用机制迈出了非常重要的一步。作为G对,发现β2肾上腺素受体与牛视紫质蛋白(rhodopsin)蛋白偶联受体相关研究所获得的第10次诺贝尔奖,这的氨基酸序列具有显著的相似性,两者都具有七次跨·337·
BriefIntroductionofNobelPrizeChineseJournalofNatureVol.34No.6膜的区域。据此,Lefkowitz和Kobilka推断rhodopsin糖蛋白类激素的受体的结构研究开辟了先河;然而,美和β2肾上腺素受体可能属于同一家族,而这一家族可中不足的是解析出来的结构缺少跨膜区的结构域[7]。能编码很多重要的激素受体。基于这一推论,Lefkowitz之后的两年中,没有其他的G蛋白偶联受体结构被解析实验室的Kobilka等很快成功克隆了编码人类β2肾上出来,对G蛋白偶联受体的研究也一直停留在利用定点腺素受体、人类血小板α2肾上腺素受体、5-羟色胺突变和半胱氨酸扫描突变的方法检测受体和配体的相(5HTA1A)受体等在内的一系列受体的基因。他们的互作用[8]。这些工作都极大地推动了G蛋白偶联受体研究的发展。G蛋白偶联受体的三维结构研究停滞的局面一直2007年,BrianK.Kobilka和他的研究团队解析出了人持续到2007年才得以打破。在这一年,BrianKobilka的β2肾上腺素受体的晶体结构,这一突破性的研究成和RaymondStevens研究组共同解析了β2肾上腺素受果拉开了人类G蛋白偶联受体晶体结构解析的序幕。体的高分辨率三维结构。在此工作中,两个研究组分别纵观β2肾上腺素受体的研究历程,我们可以想象出这做出了开创性的贡献:BrianKobilka首次运用在受体中项工作的艰巨,花费如此长的时间才得到其三级结构也插入可溶性蛋白片段的方法,这一可溶蛋白片段能显著就不足为奇了。提高受体的稳定性,并且有效地辅助晶体形成;Ray-mondStevens则将脂立方相(lipidiccubicphase)这一结晶学新概念引入G蛋白偶联受体的结构研究中,并进一2G蛋白偶联受体的结构研究步发展出如FRAP,LCP-Tm等一系列脂立方相工具用通过结构预测,研究人员很早就得知G蛋白偶联受于结晶实验。随着融合蛋白和脂立方相概念的推广,G体的结构为一个由7个α螺旋组成的跨膜结构,此外一蛋白偶联受体的三维结构解析不再是一个个单独的个小部分受体还包含胞外的N端或胞内的C端结构域,与案,开始变得有迹可循。至今研究人员共解析了14个此同时,早期的一些结构生物学研究得到的较低分辨率G蛋白偶联受体的三维结构,其中有12个受体的结构的结构也给出了这7个α跨膜螺旋的大致走向。但是解析采用了融合蛋白和脂立方相的方法,这些结构也基这些粗略的结构无法解释为何同样是七次跨膜结构,数本上都是由这两家实验室完成或者参与完成的。百个不同的G蛋白偶联受体家族却能特异地识别小到在解析了β2肾上腺素受体的结构之后,BrianKo-光子,大到蛋白这些无论在体积还是在形状、性质上均bilka和RaymondStevens研究组的研究方向开始有了有很大差别的底物分子,以及底物分子结合后,受体又不同的侧重。其中,RaymondStevens研究组更侧重于是如何将信号进一步传递给不同的细胞内信号通路的。新的受体结构解析。他们又陆续解析了A2A腺苷受G蛋白偶联受体的三维结构解析工作历来被认为是最体,CXCR4趋化因子受体以及D3多巴胺受体等7个有挑战性的结构生物学研究之一,早期研究人员在此方受体的三维结构。这些新解析出的结构表明,虽然同向上花费了无数的心血却进展甚微。研究人员第一次样是七次跨膜,但是小分子受体、磷脂分子受体、小分了解G蛋白偶联受体的结构来自于对视紫红质二维结子和多肽受体等在跨膜螺旋的走向以及胞外环的结构构的检测,虽然当时得到的结构分辨率比较低,却第一上都有许多不同的结构特征,而这些结构特征又与其次观察到G蛋白偶联受体跨膜区域的构象,成为其他G生理功能息息相关。在这些结果的帮助下,研究人员蛋白偶联受体研究的分子模型[2-4]。2000年,Science杂已经初步掌握一些G蛋白偶联受体与其配体识别并志的封面文章介绍了视紫红质晶体结构的研究结果,从相互作用的规律,并可据此对未知受体的相关信息进而揭开了G蛋白偶联受体结构的神秘面纱,成为G蛋行预测。当然RaymondStevens研究组的结果也表白偶联受体结构研究领域中的一个重要里程碑,奠定了明,这一预测仅仅局限于一小部分我们了解得比较清其他G蛋白偶联受体结构研究的基础[5]。视紫红质作楚的受体中,而针对大部分受体的预测仍然与实验数为G蛋白偶联受体结构研究的模型也有其天然的优势:据相差甚远[9]。一方面人们可以从牛视网膜中获得大量高纯度的视紫与RaymondStevens研究组不同,BrianKobilka研红质,另外一方面则因为视紫红质非常稳定,在其他G究组在解析了β2肾上腺素受体的结构之后更偏重于信蛋白偶联受体变性的环境中仍然能保持活性状态[2,6]。号传导的研究。他们仍然以β2肾上腺素受体为模型,2005年,WayneA.等获得了FSHR(follicle-stimulating进一步解析了其与拮抗剂、激动剂以及G蛋白这一重要hormonereceptor)N端配体结合结构域与配体结合的下游信号分子等各种复合物的三维结构。这些结果帮复合体,其晶体结构研究成果在Nature上发表,为结合助研究人员进一步认识不同类型底物如何被受体识别,·338·
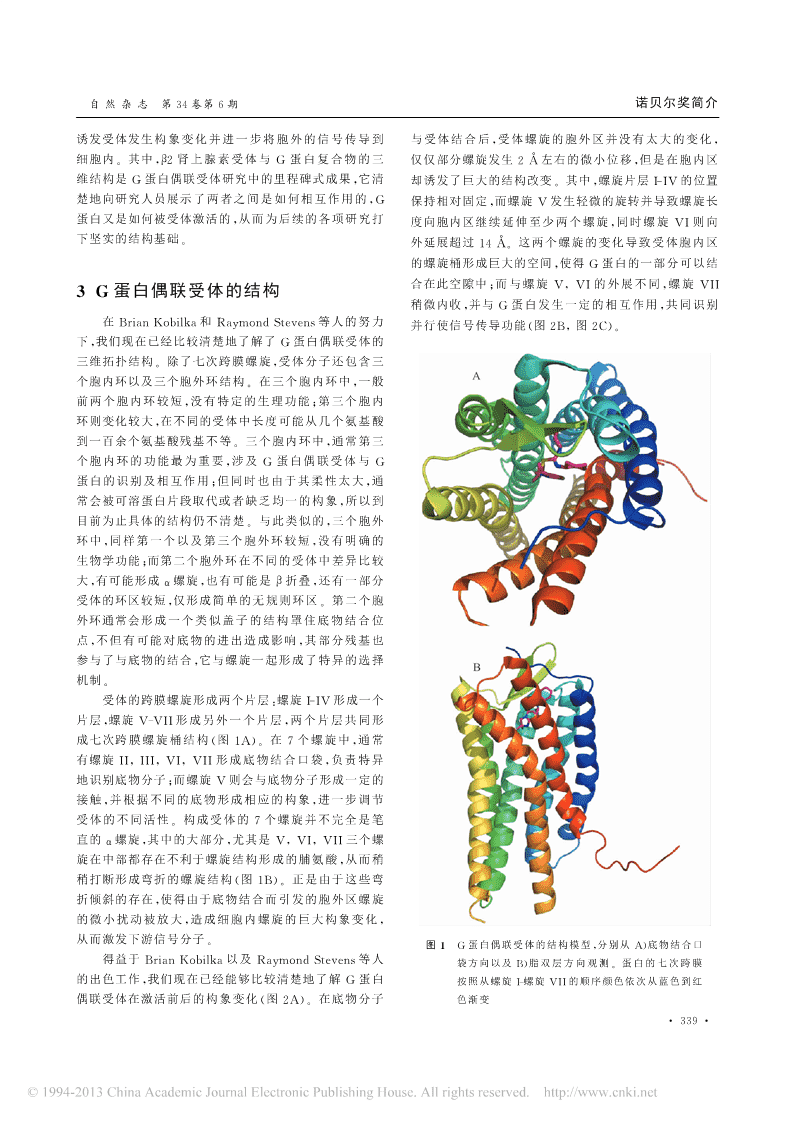
自然杂志第34卷第6期诺贝尔奖简介诱发受体发生构象变化并进一步将胞外的信号传导到与受体结合后,受体螺旋的胞外区并没有太大的变化,细胞内。其中,β2肾上腺素受体与G蛋白复合物的三仅仅部分螺旋发生2左右的微小位移,但是在胞内区维结构是G蛋白偶联受体研究中的里程碑式成果,它清却诱发了巨大的结构改变。其中,螺旋片层I-IV的位置楚地向研究人员展示了两者之间是如何相互作用的,G保持相对固定,而螺旋V发生轻微的旋转并导致螺旋长蛋白又是如何被受体激活的,从而为后续的各项研究打度向胞内区继续延伸至少两个螺旋,同时螺旋VI则向下坚实的结构基础。外延展超过14。这两个螺旋的变化导致受体胞内区的螺旋桶形成巨大的空间,使得G蛋白的一部分可以结合在此空隙中;而与螺旋V,VI的外展不同,螺旋VII3G蛋白偶联受体的结构稍微内收,并与G蛋白发生一定的相互作用,共同识别在BrianKobilka和RaymondStevens等人的努力并行使信号传导功能(图2B,图2C)。下,我们现在已经比较清楚地了解了G蛋白偶联受体的三维拓扑结构。除了七次跨膜螺旋,受体分子还包含三个胞内环以及三个胞外环结构。在三个胞内环中,一般前两个胞内环较短,没有特定的生理功能;第三个胞内环则变化较大,在不同的受体中长度可能从几个氨基酸到一百余个氨基酸残基不等。三个胞内环中,通常第三个胞内环的功能最为重要,涉及G蛋白偶联受体与G蛋白的识别及相互作用;但同时也由于其柔性太大,通常会被可溶蛋白片段取代或者缺乏均一的构象,所以到目前为止具体的结构仍不清楚。与此类似的,三个胞外环中,同样第一个以及第三个胞外环较短,没有明确的生物学功能;而第二个胞外环在不同的受体中差异比较大,有可能形成α螺旋,也有可能是β折叠,还有一部分受体的环区较短,仅形成简单的无规则环区。第二个胞外环通常会形成一个类似盖子的结构罩住底物结合位点,不但有可能对底物的进出造成影响,其部分残基也参与了与底物的结合,它与螺旋一起形成了特异的选择机制。受体的跨膜螺旋形成两个片层:螺旋I-IV形成一个片层,螺旋V-VII形成另外一个片层,两个片层共同形成七次跨膜螺旋桶结构(图1A)。在7个螺旋中,通常有螺旋II,III,VI,VII形成底物结合口袋,负责特异地识别底物分子;而螺旋V则会与底物分子形成一定的接触,并根据不同的底物形成相应的构象,进一步调节受体的不同活性。构成受体的7个螺旋并不完全是笔直的α螺旋,其中的大部分,尤其是V,VI,VII三个螺旋在中部都存在不利于螺旋结构形成的脯氨酸,从而稍稍打断形成弯折的螺旋结构(图1B)。正是由于这些弯折倾斜的存在,使得由于底物结合而引发的胞外区螺旋的微小扰动被放大,造成细胞内螺旋的巨大构象变化,从而激发下游信号分子。图1G蛋白偶联受体的结构模型,分别从A)底物结合口得益于BrianKobilka以及RaymondStevens等人袋方向以及B)脂双层方向观测。蛋白的七次跨膜的出色工作,我们现在已经能够比较清楚地了解G蛋白按照从螺旋I-螺旋VII的顺序颜色依次从蓝色到红偶联受体在激活前后的构象变化(图2A)。在底物分子色渐变·339·
BriefIntroductionofNobelPrizeChineseJournalofNatureVol.34No.64β2肾上腺素受体研究进展近40年来,β2肾上腺素受体都作为G蛋白偶联受体家族研究的模型,它是第一个通过放射性配体结合进行研究的G蛋白偶联受体,也是第一个用结晶学方法进行结构研究的神经递质受体[6,10,12-13]。尽管越来越多的证据表明,GPCR存在二聚体,并且这些二聚体可能与一些GPCR的活化有关[2],然而β2肾上腺素受体的活化不需要发生二聚化,其在晶体结构中以单体形式存在,而且纯化的β2肾上腺素受体也以单体形式存在,单体的β2肾上腺素受体整合到重组的高密度脂蛋白颗粒,从而与Gs蛋白偶联[14]。激动剂与β2肾上腺素受体结合后促进了其与GDP结合的αβr异源三聚体的相互作用,导致GDP和GTP的交换,Gs分离为Gα-GTP和Gβr亚基,分离后的两个亚基可以调控不同细胞效应因子的活性,Gαs固有的GTP酶活性将GTP水解为GDP,而Gα-GDP和Gβr重新结合后终止了信号的传导(图3)。β2肾上腺素受体被肾上腺素激活后,在心血管疾病以及肺功能方面有着重要的作用,人们已经通过定点突变的方法鉴定出β2肾上腺素受体与配体相互作用的位点[10]。在β2肾上腺素受体中存在着一定的结构疏松区域,蛋白酶敏感实验和分子内荧光共振能量转移实验表明疏松的结构主要位于β2肾上腺素受体的C末端和第三个胞内环,这些区域在蛋白-蛋白之间的相互作用过程中有着重要的作用。对于水溶性蛋白来说,去除这些结构疏松区有利于晶体的形成,而对于β2肾上腺素受体来说,这样的做法会减少它的亲水表面进而导致晶格间的相互联系。β2肾上腺素受体中C端结构域的第二和第三个胞质环参与了与G蛋白的相互作用,通过N端结构域和第三个胞内环的C端促进G蛋白的活化,C端结构域则与G蛋白偶联受体激酶、抑制剂和其他的一些信号分子相互作用[15-17]。为了进一步对β2肾上腺素受体的结构和功能进行图2G蛋白偶联受体的激活。A)G蛋白偶联受体与研究,理解G蛋白偶联受体信号传导的结构基础,BrianG蛋白复合物的三维结构。其中,浅褐色部分代K.Kobilka尝试获得β2肾上腺素受体-Gs蛋白复合体。表G蛋白偶联受体,绿色代表G蛋白α亚基,天然而这样的工作面临一个很大的问题,就是在去垢剂存蓝色代表G蛋白β亚基,紫色代表G蛋白γ亚在的条件下如何得到稳定的β2AR-Gs复合体。虽然基。B)G蛋白偶联受体处于活性与非活性状态β2AR-Gs在磷脂双分子层中可以有效地发生偶联,但是的胞内结构比较。其中绿色和蓝色分别代表活[10]在加入去垢剂后其偶联效率急剧下降。后来BrianK.性状态下以及非活性状态下的受体结构。C)Kobilka发现在十二烷基麦芽糖苷溶液中,纯化的GDP-G蛋白偶联受体处于活性与非活性状态的胞内结构比较示意图[11]。箭头代表相应的区域在受Gs和过量的与高亲和力配体结合的β2肾上腺素受体可以形成复合体[17],然后加入三磷酸腺苷双磷酸酶将体激活后发生的结构变化·340·
自然杂志第34卷第6期诺贝尔奖简介图3β2AR-Gs蛋白复合物中G蛋白循环示意图[12]GDP从Gs-GDP复合体上水解下来,就能够得到稳定的DNA损伤的积累。在这篇文章中RobertJ.Lefkowitzβ2AR-Gs复合体。在这个过程中,将GDP从复合体上还解释了β抑制蛋白新的功能,即在细胞核中作为E3水解下来是非常有必要的,因为GDP或者GTP的存在连接酶的连接子,促进E3连接酶与P53的相互作用,进都会破坏β2肾上腺素受体和Gs的相互作用。2011年而导致了P53的泛素化程度增加,最后发生降解[19]。他BrianK.Kobilka终于顺利解析出了β2AR-Gs蛋白复的这一发现再次引起轰动,为肿瘤以及神经系统等相关合体的晶体结构,研究成果发表在Nature上。他发现疾病的诊断提供了理论依据。同年,RobertJ.在这个复合体中,Gs与GTP的亲和力远高于其与GDPLefkowitz和他的研究团队利用质谱定量分析的策略,的亲和力,并且当β2肾上腺素受体与Gs结合后与配体用同位素和琥珀酰苷分别标记半胱氨酸的巯基和赖氨的亲和力比β2肾上腺素受体单独存在时高出了近100酸的氨基,检测标记的氨基酸的特定反应来研究β2肾倍。β2AR-Gs复合体结构的解析是人们第一次通过一上腺素受体与不同的配体结合时动态的构象变化。这个G蛋白偶联受体来研究横跨质膜的信号传导机制,为种方法提供了各自侧链特定的反应信息,鉴定了β2肾激动剂-β2AR-Gs三聚体的功能分析提供了结构基[20]上腺素受体与不同配体结合时的构象变化。Robert础[10]。同年,BrianK.Kobilka又实现了另一突破,他J.Lefkowitz和BrianK.Kobilka在GPCR领域所取利用抗体片段代替G蛋白,成功得到了抗体片段-激动得的成就令人折服,他们创造性的研究方法也为今后剂-活化的β2肾上腺素受体三者的复合体,捕捉到在向GPCR的研究工作开辟了蹊径。细胞发送信号时的β2肾上腺素受体图像。与之前只能解析出非活化状态的G蛋白偶联受体结构相比,他的这一工作使G蛋白偶联受体结构和功能的研究又上了一5G蛋白偶联受体研究现状及问题个新的台阶[18]。与BrianK.Kobilka在β2肾上腺素受体结构解析G蛋白偶联受体的7个跨膜疏水区有很高的保守方面作出的贡献相比,RobertJ.Lefkowitz则对β2肾性,而N端、C端和跨膜结构域之间的连接区保守性相上腺素受体的功能及其介导的信号通路做了深入的研对比较低。不同种类的配体在G蛋白偶联受体上的结究,尤其对β-抑制蛋白在信号通路中的作用机制及功能合位点也不相同,小分子配体主要结合在G蛋白偶联受做了全面解析。2011年,RobertJ.Lefkowitz阐述了慢体7个α螺旋跨膜结构围成的疏水区,肽段和蛋白质结性应激反应和DNA损伤之间的关系,其研究成果在合的区域则位于N端结构域和胞外的亲水环[21-22]。根Nature上发表。流行病学研究已经证实慢性应激反应会导致DNA损伤,应激反应诱导了DNA损伤后会加快据序列同源性和功能相似性进行区分,G蛋白偶联受体人体老化,引发肿瘤形成以及一些精神疾病的发生,但一共可以分为六大类,每一大类又可以分为很多不同的是人们对DNA损伤的机制还不清楚。在这篇文章里亚类,其中数目最多的视紫红质样受体可以分为19个RobertJ.Lefkowitz就对其分子机制做了详细的阐述,亚类。配体也可以根据其与受体结合后产生不同的效儿茶酚胺类配体与β2肾上腺素受体结合后,活化了β2应分为几类:第一类是完全激动剂,与受体结合后可以肾上腺素受体,通过Gs-PKA和β-抑制蛋白信号通路,最大程度地激活受体;第二类是部分激动剂,在饱和浓分别造成DNA的损伤和P53水平的下降,协同导致了度下也不能完全激活受体;第三类是中立的拮抗剂,与·341·
BriefIntroductionofNobelPrizeChineseJournalofNatureVol.34No.6受体结合后不产生明显的信号传导效应,但是却可以阻体中,另外一种就是这种相互作用非常弱以致在晶体生止其他的配体与受体结合;还有一类就是拮抗剂,与受长的过程中消失[23]。体结合后会降低受体的本底活性。受体的活性因所结受体活化可能主要通过两种机制:首先是配体的结合配体种类的不同会增加或者下降,这样看来,G蛋白合打破G蛋白偶联受体胞质内固有的相互作用,即破坏偶联受体就更像是一个分子变阻器而不是一个简单的离子锁附近的结构;其次是产生新的相互作用,包括配分子活性开关,与配体结合后既可以表现出最大的活体上化学取代基和G蛋白偶联受体上特定氨基酸残基性,也可以表现出不同程度的部分活性。找出不同G蛋之间的相互作用等等,这是一个非常复杂的过程。配体白偶联受体亚类作用机制和功能的不同是一项非常有就像一座桥,介导G蛋白偶联受体跨膜结构域之间的联意义的工作,尤其是对于那些高度保守的成员,区分不系,进而形成一个更加有活性的构象状态,并且影响跨膜结构域的空间排布[22]。同的受体类型后就可以采用相应的药物进行治疗。通常可以采取两种方法区分不同的G蛋白偶联受体亚类:G蛋白偶联受体是一种多能的信号分子,这可能源第一种就是鉴定出受体的类型及其调控的生理过程,另于它们灵活多变的三维空间结构。先前采用生物传感一种就是找出可以选择性地与相应的一个或者一类受器和体外荧光标记的方法研究七次跨膜蛋白存在的不体结合的配体。但是,传统的药物疗法通常不能区分同同的构象,尽管这些研究可以观察到激动剂诱导的受体源性比较高的G蛋白偶联受体,所以,尽管利用选择性构象的变化,但是并不十分准确,而且缺乏系统性。同配体对G蛋白偶联受体功能的研究非常重要,却很难找时,尽管X射线衍射已解析出多种七次跨膜蛋白结构,到选择性很高的配体[21]。可以提供静态原子水平的结构信息,但是仍然存在一定研究表明G蛋白偶联受体存在多种、配体特异性的的局限性。为了获得这些动态分子高分辨率的晶体衍构象状态。BrianK.Kobilka曾经用能量图的方式直观射数据,我们会采取一定措施减少这些受体结构的灵活地描述蛋白受体构象动态变化的过程,他把没有结合配性,例如用T4L取代高度可变的ICL3以及与抗体共结体时的受体状态定义为最低能量状态,不同的构象之间晶以稳定受体构象,所以这些结构并不能展示未经修饰存在着能量差异,即低能量构象状态向高能量构象状态的七次跨膜区复杂的动态过程。寻找能够检测跨膜区转化时,需要克服一定的能垒,能量变化的宽度则反映动态变化过程的方法对于研究其在信号转导过程中的出受体构象变化的灵活性。对于一个受体来说,配体结作用和活化的机制就显得尤为重要,更好地理解这些动态特征对基于结构的药物研发来说有着重要的意义[20]。合的能量可以作为非活化状态到活化状态所需的能量,也可以用来减少或增加了两种状态间的能量差值,或者然而,这种动态的变化也给结构分析带来了巨大的挑两种情况都存在[22]。战。晶体的形成需要稳定的、构象均一的蛋白,人们很与视紫红质不同,很多G蛋白偶联受体表现出不依难获得没有结合配体的天然的G蛋白偶联受体晶体;即赖配体结合的本底活性,例如β2肾上腺素受体因其开便获得了这样的晶体,也可能只是得到了晶体众多天然放的结构使得它在结合抑制剂的情况下仍保留了一部构象中的一种。尽管目前的NMR技术还很难获得高分分的本底活性。受体的本底活性与结构的不稳定有关,辨率的晶体结构数据,但是NMR是研究这些蛋白动态过程的最有可能的方法[23]。分子内的相互作用使受体维持在非活化状态,G蛋白偶联受体第三个跨膜区存在一段保守序列E/DRY,它们可以和第六个跨膜区上的谷氨酸残基形成离子锁,这也6G蛋白偶联受体研究展望是配体活化的G蛋白偶联受体和视紫红质在结构上的一个主要差别。在A类G蛋白偶联受体家族中,这些随着技术的不断改进,现在解析出一种G蛋白偶联氨基酸残基通过极性相互作用形成一个网络结构,像一受体结构所需要的时间也越来越短,到目前为止,已经座桥梁一样连接着两个跨膜螺旋,稳定了非活化状态的有十几种G蛋白偶联受体的结构被解析出来。G蛋白构象。对于β2肾上腺素受体来说,这些位点的突变可偶联受体研究工作快速推进的同时,也对人们提出了更以增加β2肾上腺素受体的本底活性,并且研究表明,完高的要求,不仅仅局限于单纯地获得其晶体结构,G蛋全激动剂和部分激动剂与受体结合后都可以改变离子白偶联受体的活化机制以及结构与功能的关系,也都成锁附近的结构,破坏分子内的相互作用。对于那些缺少为人们关注的焦点。G蛋白偶联受体活化时都发生了完整的离子锁的晶体来说,可能有两种原因造成这种情哪些构象变化,配体是通过什么机制诱导了受体构象的况:第一种是因为这种相互作用不存在于结合配体的受变化等等一系列的问题都亟待解决。晶体结构信息对·342·
自然杂志第34卷第6期诺贝尔奖简介G蛋白偶联受体药物的研发有很大的帮助,虽然越来越1266-1273.[14]WHORTONMR.AmonomericGprotein-coupledreceptor多的G蛋白偶联受体晶体结构被解析出来,但是这些模isolatedinahighdensitylipoproteinparticleefficientlyacti-型对药物研发者来说仍然显得不够精确。分子停靠实vatesitsGprotein[J].ProcNatlAcadSciUSA,2007,104:验表明,非活化状态的G蛋白偶联受体结构只有在鉴定7682-7687.[15]GRANIERS.StructureandconformationalchangesintheC-那些稳定非活化状态结构的配体时结果才可信[23];因此terminaldomainoftheβ2-adrenoceptor:insightsfromfluo-除了对G蛋白偶联受体进行结晶外,还需要发展一些新rescenceresonanceenergytransferstudies[J].JBiolChem,的方法去获得受体和激动剂结合时的结构。只有G蛋2007,282:13895-13905.[16]GETHERU,KOBILKABK.Gprotein-coupledreceptors.白偶联受体与激动剂结合才能提供受体活化状态的三II.mechanismofagonistactivation[J].JBiolChem,1998,维构象,这些结构将有助于阐明构象变化与配体结合之273:17979-17982.[17]REITERE,LEFKOWITZRJ.GRKsandβ-arrestins:roles间的关系,G蛋白偶联受体靶向的药物疗法既包括激动inreceptorsilencing,traffickingandsignaling[J].Trends剂也包括反激动剂,所以这些结构将会对药物化学和药EndocrinolMetab,2006,17:159-165.理学的研究产生深远的影响。[18]RASMUSSENSGF,CHOIHJ,FUNGJJ,etal.Structureofananobody-stabilizedactivestateoftheβ2adrenoceptor(2012年11月20日收到)[J].Nature,2011,469:175-180.[19]HARAMR,KOVACSJJ,LEFKOWITZRJ.Astressre-[1]PIERCEKL,PREMONTRT,LEFKOWITZRJ.SevensponsepathwayregulatesDNAdamagethroughβ2-adrenore-transmembranereceptors[J].NatureRevMolCellBiol,ceptorsandβ-arrestin-1[J].Nature,2011,477:349-353.2002,3:639-650.[20]KAHSAIAW,XIAOK,LEFKOWITZRJ.Multipleligand-[2]KOBILKABK.Gproteincoupledreceptorstructureandac-specificconformationsoftheβ2-adrenergicreceptor[J].Nattivation[J].BiochimBiophysActa,2007,1768(4):794-ChemBiol,2011,7:692-700.807.[21]ROHRERDK,KOBILKABK.Gprotein-coupledrecep-[3]UNGERVM,HARGRAVEPA,BALDWINJM,etal.tors:functionalandmechanisticinsightsthroughalteredgeneArrangementofrhodopsintransmembranealpha-helices[J].expression[J].PhysiologicalReviews,1988,78:35-52.Nature,1997,389:203-206.[22]KOBILKABK,DEUPIX.ConformationalcomplexityofG-[4]SCHERTLERGF,VILLAC,HENDERSONR.Projectionprotein-coupledreceptors[J].TrendsinPharmacologicalSci-structureofrhodopsin[J].Nature,1993,362:770-772.ences,2007,28:398-406.[5]PALCZEWSKIK,KUMASAKAT,MIYANOM.Crystal[23]ROSENBAUMDM,KOBILKABK.Thestructureandfunc-structureofrhodopsin:aGprotein-coupledreceptor[J].Sci-tionofG-protein-coupledreceptors[J].Nature,2009,459:ence,2000,289:739-745.356-363.[6]RASMUSSENSGF,CHOIHJ,ROSENBAUMDM,etal.Crystalstructureofthehumanβ2adrenergicG-protein-cou-pledreceptor[J].Nature,2007,450:383-387.GProteinCoupledReceptors,theMagicMolecules[7]FANQR,HENDRICKSONWA.Structureofhumanfolli-withSevenTransmembraneHelices:ABriefIntro-cle-stimulatinghormoneincomplexwithitsreceptor[J].Na-ture,2005,433:269-277.ductiontotheNobelPrizeinChemistry2012[8]SHIL,JAVITCHJA.ThebindingsiteofaminergicGpro-①,WUBei-li②,ZHAOQiang③LUWei-zhentein-coupledreceptors:thetransmembranesegmentsandsec-①②③Professor,CASKeyLaboratoryofReceptorResearch,ondextracellularloop[J].AnnuRevPharmacolToxicol,ShanghaiInstituteofMateriaMedica,ChineseAcademyofSciences,2002,42:437-467.Shanghai201203,China[9]MICHINOM,CHENJ,STEVENSRC.FoldGPCR:struc-AbstractGproteincoupledreceptorsarethelargestandthemostturepredictionprotocolforthetransmembranedomainofGimportantproteinfamilyinhumangenome,whichinvolvedinal-proteincoupledreceptorsfromclassA[J].Proteins,2010,mostallofthelivingactivities.Thegenecloning,functionalstudies78:2189-2201.andstructuraldeterminationofthesereceptorsshedanewlighton[10]RASMUSSENSGF,DEVREEBT,ZOUY,etal.Crystalunderstandingthephysiologicalregulationandthepathogenicitystructureoftheβ2adrenergicreceptor-Gsproteincomplexandtreatmentofalmostallthehumandiseases.TheNobelPrize[J].Nature,2011,477:549-555.hadissuedtorelatedresearchfor9times,andin2012,theNobel[11]XUF,WUH,KATRITCHV,etal.Structureofanagonist-PrizeinChemistrywasissuedtotwoAmericanscientists,RobertJ.boundhumanA2Aadenosinereceptor[J].Science,2011,LefkowitzandBrianK.Kobilka,fortheirextraordinaryworkon332:322-327.thisarea,especiallyonβ2adrenergicreceptors.Inthispaper,we[12]DIXONRAF,KOBILKABK,STRADERDJ,etal.Clo-brieflyreviewedtheresearchprogressesofGproteincoupledrecep-ningofthegeneandcDNAformammalianβ-adrenergicre-torsinthepast,theirunique7transmembranearchitecture,activa-ceptorandhomologywithrhodopsin[J].Nature,1986,321:tionmechanismandtheirfuturetrends.KeywordsGproteincoupledreceptor,adrenergicreceptor,75-79.[13]ROSENBAUMDM,CHEREZOVV,HANSONMA,etal.7transmembranearchitectureGPCRengineeringyieldshigh-resolutionstructuralinsightsin-toβ2-adrenergicreceptorfunction[J].Science,2007,318:(编辑:沈美芳)·343·
您可能关注的文档
- 工程力学 第22章 达朗贝尔原理
- 第十三章追踪北京2005年诺贝尔经济学奖论坛
- 瞄准疾病的利器——英美科学家因基因靶向技术获2007年诺贝尔生理学或医学奖
- 不对称信息市场理论与信息经济学_2001年诺贝尔经济学奖得主主要理论简述
- 社会管理创新视角下的呼伦贝尔市社区工作者队伍建设研究
- 20世纪诺贝尔文学奖
- 内蒙古呼伦贝尔大草原、长白山天池、沈阳故宫、安阳空调
- 克洛斯贝尔创立纪念祭
- 实证宏观经济学的因果分析范式_2_省略_度诺贝尔经济学奖获得者的学术贡献_赵晶
- 贝尔法斯特女王大学工艺学硕士专业
- 从诺贝尔物理学奖看光学的发展
- 东莞贝尔上海分公司动力电池检测设备
- 现代财政学之父理查德阿贝尔马斯格雷夫
- 福禄贝尔学前教育思想在的引进及影响
- 关于呼伦贝尔地区四少民族中学生断面文化传承的差异性调查研究
- 化学动力学的发展与百年诺贝尔化学奖
- 诺贝尔生理学或医学奖1901-2000年(英文资料篇)
- 阿贝尔群中给定度的凯莱图和Hypohamiltonian图的线性k荫度.pdf