- 191.48 KB
- 2022-06-16 12:40:58 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
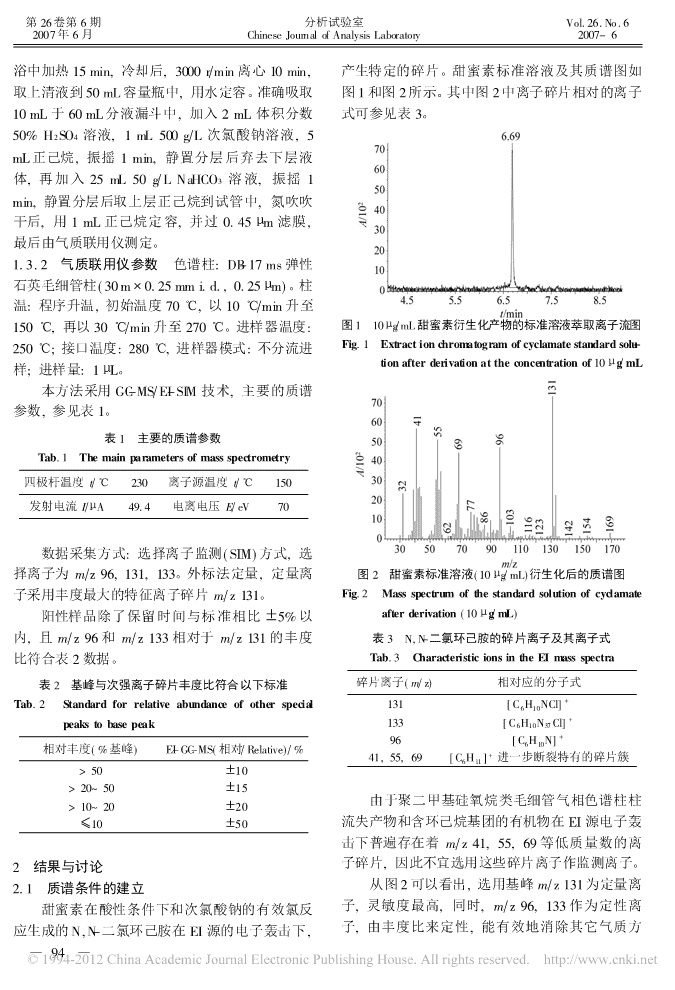
第26卷第6期分析试验室Vol.26.No.62007年6月ChineseJournalofAnalysisLaboratory2007-6气质联用法测定含蛋白食品中的甜蜜素沈伟健,黄娟,沈崇钰,林宏,赵增运,陈惠兰,徐锦忠X(江苏出入境检验检疫局食品实验室,南京210001)摘要:建立了一种用于检测含蛋白食品中甜蜜素的方法。用三氯乙酸对样品进行蛋白变性,次氯酸钠作衍生剂将甜蜜素定量转化为N,N-二氯环己胺,正己烷萃取与基体分离后由气相色谱-质谱联用技术进行测定。在2~50LgPmL范围内方法的线性良好,5,10和25mgPkg等3个添加水平下,回收率稳定在7510%~10010%之间,RSD[1211%,灵敏度高,检出限为110mgPkg。关键词:含蛋白食品;甜蜜素;气相色谱-质谱联用;确证方法中图分类号:O657.63文献标识码:A文章编号:1000-0720(2007)06-093-03甜蜜素化学名为环己基氨基磺酸钠,是一种阳性结果。非营养性的低热量合成甜味剂,有良好的水果风本文运用三氯乙酸对样品基质中的蛋白进行味,甜度可为白糖50~60倍,且口感好,价格低变性净化,酸性条件下次氯酸钠衍生化生成N,N-廉,被广泛应用于饼干、糕点、冷冻食品、调味二氯环己胺,由气相色谱-质谱联用法测定。该方品、果酱、果冻、清凉饮料、蜜饯等。近年来发现法步骤简单,稳定性好;准确度和灵敏度高;通过甜蜜素可能有致癌性,其代谢产物环己胺对心血改变衍生化反应体系改善质谱性能,提高了抗干管系统和睾丸有毒理作用,因此日本等国已经禁扰能力,能有效消除了测定结果出现假阳性的可止甜蜜素作食品添加剂来使用。有关的检验方法能,可作为确证方法用于含蛋白食品中甜蜜素的[1][2]有紫外分光光度法、离子色谱法、气相色谱测定。[3][4][5,6]法,液相色谱法和气相色谱-质谱联用法。1实验部分其中,液相色谱法是目前应用较为普遍的方法,1.1试剂选择紫外检测器低波长进行分析时容易受基质的浓H2SO4,三氯乙酸,次氯酸钠,正己烷,干扰。气相色谱法也存在干扰现象,尤其是在分NaHCO3均为分析纯。蒸馏水或去离子水。环己基析富含蛋白的基质可靠性就更差,检测结果的假氨基磺酸钠标准品(纯度99.5%)。阳性率较高,一般适合作初筛方法。也有文献报甜蜜素标准溶液(1mgPmL):称取100.0mg[5,6]道气质联用法用于食品中甜蜜素的测定,其前甜蜜素标准品,水溶解后定容100mL。然后再用处理中运用亚硝酸钠在酸性条件下对甜蜜素进行水逐级稀释标准液,配制成10.0和100.0LgPmL衍生化,生成的环己基亚硝酸酯在EI源下得到的标准工作溶液。碎片离子为83,55,41,27mPz,但事实上这些离1.2仪器子只是由衍生化产物中的环己基基团带来的,而Agilent6890NGC-5973InertMS气相色谱-质谱非环己基亚硝酸酯本身的特征离子。而且聚二甲联用仪;涡旋混合器;离心机。基硅氧烷类毛细管柱柱流失物在EI源下也广泛存1.3方法在着这些碎片,因此以这些离子作为监测离子,1.3.1样品前处理称取5g含蛋白食品样品尤其在低浓度时很难消除由柱流失物和含环己烷(精确到0.01g)于离心瓶中,加入30mL水和2基团的其它有机物带来的干扰,导致容易出现假mL体积分数50%三氯乙酸,涡旋1min,放入沸水X收稿日期:2006-06-28;修订日期:2006-09-01作者简介:沈伟健(1978-),男,工程师)93)
第26卷第6期分析试验室Vol.26.No.62007年6月ChineseJournalofAnalysisLaboratory2007-6浴中加热15min,冷却后,3000rPmin离心10min,产生特定的碎片。甜蜜素标准溶液及其质谱图如取上清液到50mL容量瓶中,用水定容。准确吸取图1和图2所示。其中图2中离子碎片相对的离子10mL于60mL分液漏斗中,加入2mL体积分数式可参见表3。50%H2SO4溶液,1mL500gPL次氯酸钠溶液,5mL正己烷,振摇1min,静置分层后弃去下层液体,再加入25mL50gPLNaHCO3溶液,振摇1min,静置分层后取上层正己烷到试管中,氮吹吹干后,用1mL正己烷定容,并过0.45Lm滤膜,最后由气质联用仪测定。1.3.2气质联用仪参数色谱柱:DB-17ms弹性石英毛细管柱(30m@0.25mmi.d.,0.25Lm)。柱温:程序升温,初始温度70e,以10ePmin升至150e,再以30ePmin升至270e。进样器温度:图110LgPmL甜蜜素衍生化产物的标准溶液萃取离子流图250e;接口温度:280e,进样器模式:不分流进Fig.1Extractionchromatogramofcyclamatestandardsolu-tionafterderivationattheconcentrationof10LgPmL样;进样量:1LL。本方法采用GC-MSPEI-SIM技术,主要的质谱参数,参见表1。表1主要的质谱参数Tab.1Themainparametersofmassspectrometry四极杆温度tPe230离子源温度tPe150发射电流IPLA49.4电离电压EPeV70数据采集方式:选择离子监测(SIM)方式,选择离子为mPz96,131,133。外标法定量,定量离图2甜蜜素标准溶液(10LgPmL)衍生化后的质谱图子采用丰度最大的特征离子碎片mPz131。Fig.2Massspectrumofthestandardsolutionofcyclamate阳性样品除了保留时间与标准相比?5%以afterderivation(10LgPmL)内,且mPz96和mPz133相对于mPz131的丰度表3N,N-二氯环己胺的碎片离子及其离子式比符合表2数据。Tab.3CharacteristicionsintheEImassspectra表2基峰与次强离子碎片丰度比符合以下标准碎片离子(mPz)相对应的分子式+Tab.2Standardforrelativeabundanceofotherspecial131[C6H10NCl]+peakstobasepeak133[C6H10N37Cl]+96[C6H10N]相对丰度(%基峰)EI-GC-MS(相对PRelative)P%41,55,69[CH]+进一步断裂特有的碎片簇611>50?10>20~50?15由于聚二甲基硅氧烷类毛细管气相色谱柱柱>10~20?20[10?50流失产物和含环己烷基团的有机物在EI源电子轰击下普遍存在着mPz41,55,69等低质量数的离2结果与讨论子碎片,因此不宜选用这些碎片离子作监测离子。2.1质谱条件的建立从图2可以看出,选用基峰mPz131为定量离甜蜜素在酸性条件下和次氯酸钠的有效氯反子,灵敏度最高,同时,mPz96,133作为定性离应生成的N,N-二氯环己胺在EI源的电子轰击下,子,由丰度比来定性,能有效地消除其它气质方)94)
第26卷第6期分析试验室Vol.26.No.62007年6月ChineseJournalofAnalysisLaboratory2007-6法容易出现假阳性的弊端。坐标作标准曲线,得到的线性方程为y=911179Q2.2蛋白变性-69311,相关系数为0.9925。根据检出限信躁比由于样品基质中的蛋白质会把甜蜜素键合或SPN=3,结合2.0LgPmL标准溶液定量离子萃取离包裹起来,因此直接用溶剂提取很难把甜蜜素充子流色谱图SPN=10,可以推断出方法的检出限大分提取出来,而用三氯乙酸作蛋白变性剂,与蛋致为1.0mgPkg。白质结合成不溶性的盐沉淀,能很好地解决含蛋2.4准确度与精密度白基质带来的低回收率的问题。通过在阴性样品中分别添加5,10和25mgPkg2.3线性范围与检出限等3个水平的标准溶液,按照前面的提取、衍生化吸取适量1.1标准工作溶液于离心管中,加和检测步骤,并且对每个添加水平作7个平行实入30mL水,然后按照衍生化步骤直接衍生化,最验,再重复做两次,最后计算平均回收率和相对终分别配制为2.0,5.0,10.0,25.0和50.0LgPmL标准偏差,以分别考察方法的准确度和精密度,系列标准工作液。按照仪器条件进样分析后,以具体数据可参见表4。质量浓度为横坐标,甜蜜素定量离子峰面积为纵表4含蛋白食品中不同添加水平下甜蜜素的回收率和相对标准偏差Tab.4TheaveragerecoveryandRSDofcyclamateatthreespikelevelsinthefoodscontainingprotein添加水平饼干汤包wP(mgPkg)平均测定值P(mgPkg)平均回收率P%RSDP%平均测定值P(mgPkg)平均回收率P%RSDP%54.692.010.84.284.012.1108.383.06.68.787.07.12521.284.85.919.778.87.8由表中数据发现,在3个添加水平下的回收[3]封雷,蒲朝文,汪瑜等.中国卫生检验杂志,率都处在7510%~10010%之间,且RSD[1211%,2002,12(3):312[4]李智红,尹艳春.色谱,1999,17(3):278这就说明运用本方法得到的数据是准确可靠的。[5]彭艳,吴卫东,吉彩霓等.食品科学,2005,26(5):186参考文献[6]姜宏,于维森,曲青等.职业与健康,2001,[1]陈少波,潘超华.分析测试学报,2000,19(3):8217(1):65[2]ChenQC,MouSF,LiuKNetal.JChromatogrA,1997,771:135Determinationofsodiumcyclamateinfoodscontainingproteinbygaschromatography-massspectrometrySHENWei-jian,HUANGJuan,SHENChong-yu,LINHong,ZHAOZeng-yun,CHENHui-lanandXUJin-*zhong(Laboratoryoffoods,JiangsuEntry-ExitInspectionandQuarantineBureauofPRC,Nanjing210001),FenxiShiyanshi,2007,26(6):93~95Abstract:Aconfirmatorymethodforthedeterminationofsodiumcyclamateinfoodscontainingproteinbygaschroma-tography-massspectrometrywasdeveloped.Proteininsamplesisdenaturizedbytrichloroaceticacid.ThencyclamatewasquantitativelyconvertedtoN,N-dichlorocyclohexylaminewithsodiumhypochlorite,andextractedbyn-hexane,anddeterminatedbygaschromatography-massspectrometry.Linearityofmethodwasgoodfrom2to50LgPmL,andtherecoverieswerestableintherangeof75.0%to100.0%atthreespikelevels(5,10and25mgPkg),andCV%[12.1%,andLOD=1.0mgPkg.Keywords:Foodscontainingprotein;Cyclamate;Gaschromatography-massspectrometry;Comfirmatorymethod)95)